Ферменты и метаболические пути. База данных KEGG
1. Общие сведения о метаболическом пути арахидоновой кислоты
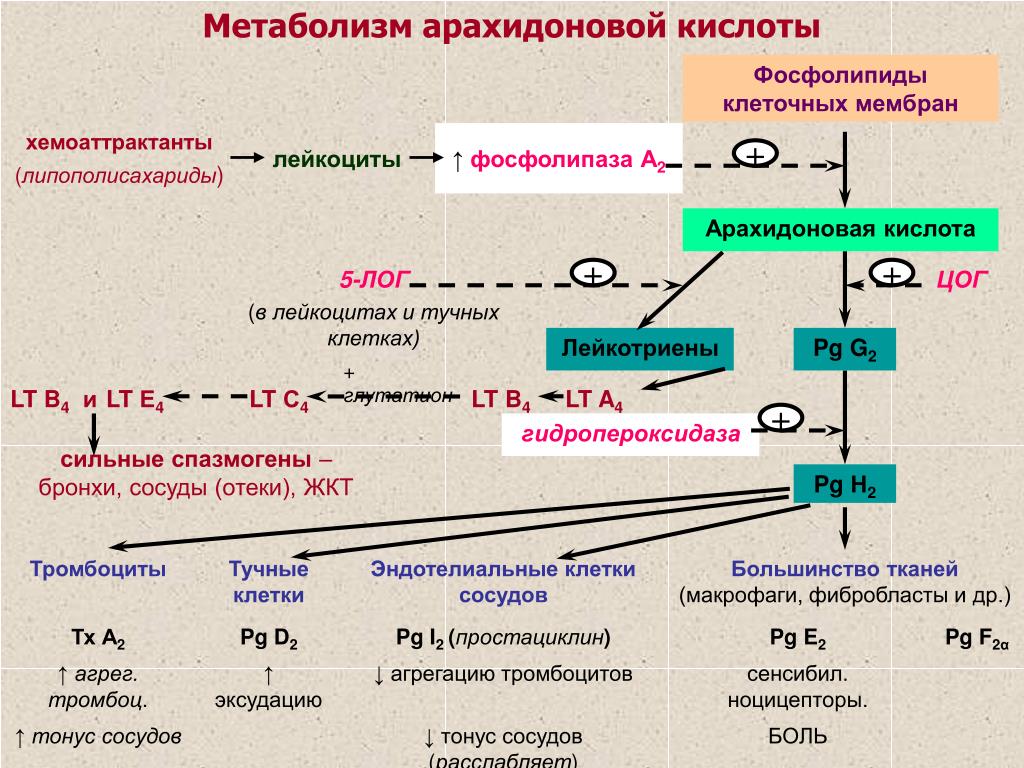
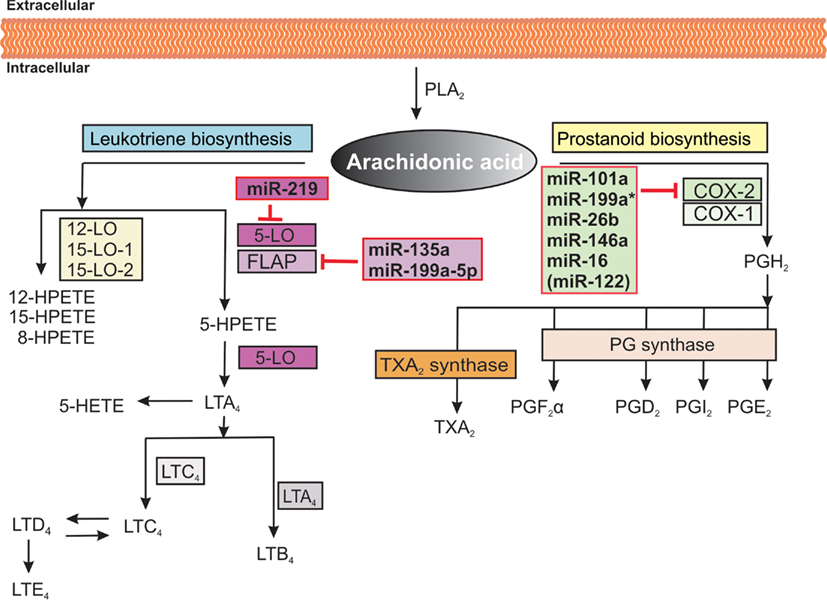
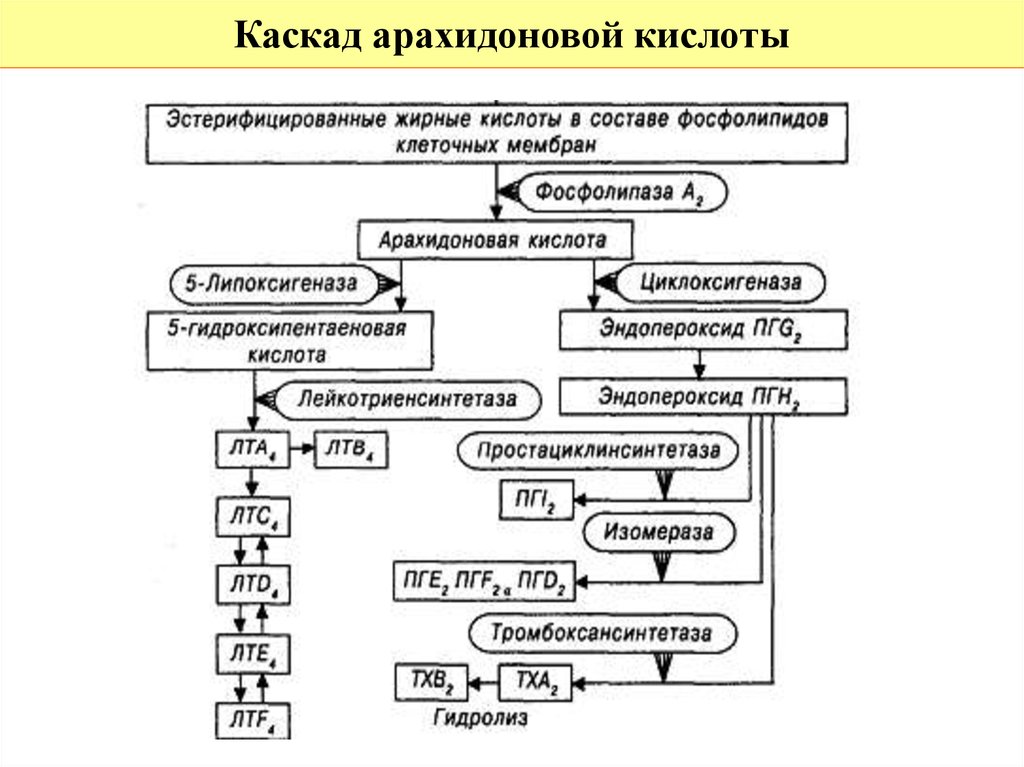
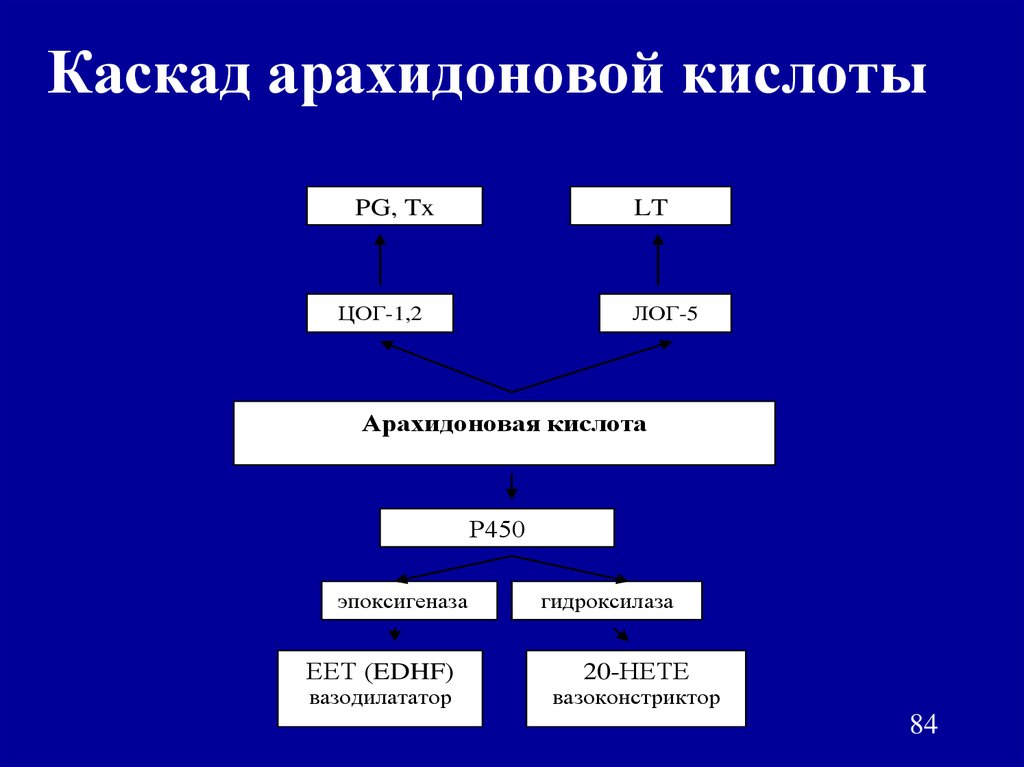
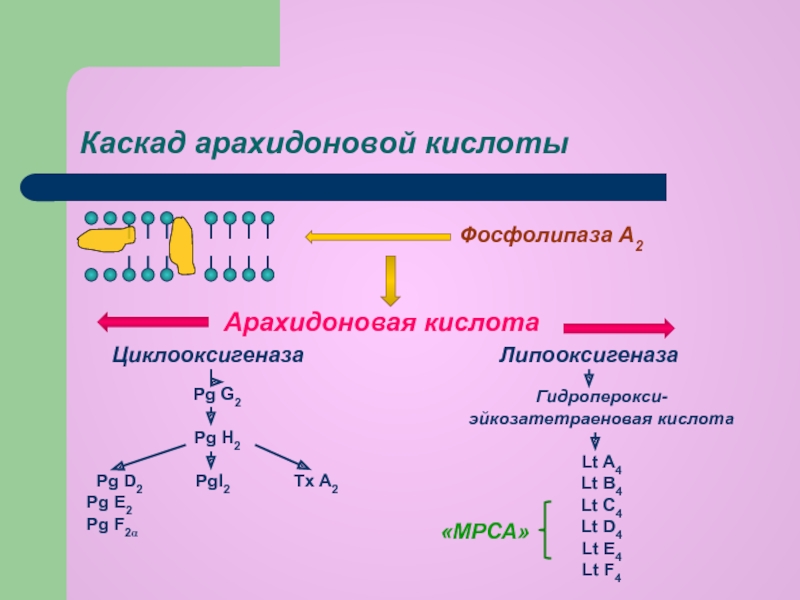
На рисунке 1 представлен каскад арахидоновой кислоты (цис-5,8,11,14-эйкозатетраеновая кислота, далее -АК). В организме человека она синтезируется из незаменимой линолевой кислоты [1] (map00591). Связь между этими двумя метаболическими путями осуществляется непосредственно через арахидоновую кислоту (на рисунке выделено синим). Источником АК для дальнейших реакций являются фосфолипиды мембран. Под действием фосфолипазы А2 АК высвобождается из мембран.Метаболиты АК, в общем случае называемые эйкозаноидами, выполняют разнообразные функции в организме. Каскад АК можно условно разделить на 3 дочерних ветви: по ферментам, которые работают с арахидоновой кислотой: циклооксигеназный путь (ферменты COX-1 и COX-2, выделено фиолетовым), липооксигеназный (5-, 12-, 15- LOX, выделено красным) и цитохром P-450 путь (выделен зеленым). Метаболиты первого пути (простагландины и тромбоксаны) вовлечены в воспалительные процессы и в процессы свертывания крови.

2. Метаболический путь арахидоновой кислоты в разных доменах жизни
Для рассмотрения метаболических путей в домене Бактерии был выбран организм Clostridium acetobutylicum ATCC 824 (Bacteria; Firmicutes; Clostridia; Clostridiales; Clostridiaceae).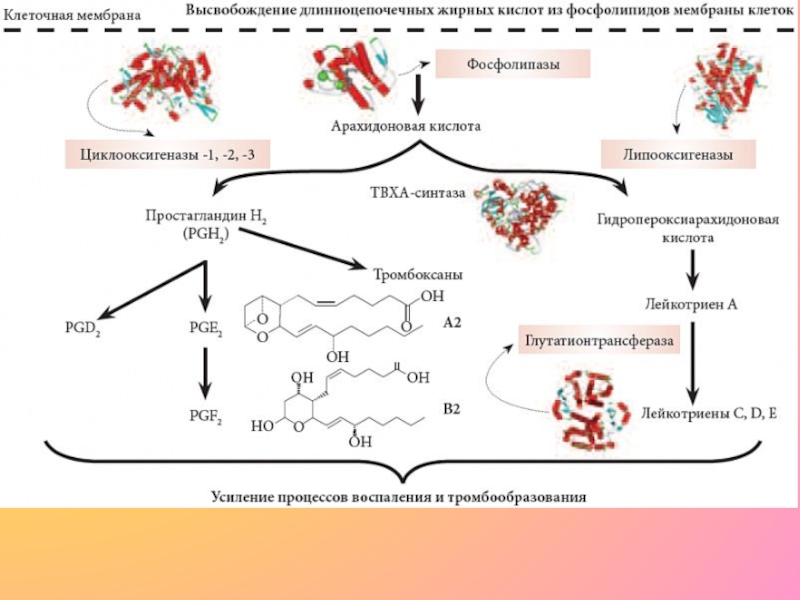 На рисунке 2 зеленым цветом выделены ферменты — участники каскада АК, экспрессирующиеся в этом организме: глутатионовая пероксидаза [EC:1.11.1.9]. Можно сделать вывод, что в данном организме этот каскад не представлен.Рисунок 2. Каскад арахидоновой кислоты (map00590) в Clostridium acetobutylicum ATCC 824. Зеленым выделены ферменты, экспрессирующиеся в этом организмеДля рассмотрения метаболических путей в домене Археи был выбран организм Methanobrevibacter olleyae (Archaea; Euryarchaeota; Methanobacteria; Methanobacteriales; Methanobacteriaceae). В этом организме экспрессируются точно такие же ферменты, что и в предыдущем организме.
На рисунке 2 зеленым цветом выделены ферменты — участники каскада АК, экспрессирующиеся в этом организме: глутатионовая пероксидаза [EC:1.11.1.9]. Можно сделать вывод, что в данном организме этот каскад не представлен.Рисунок 2. Каскад арахидоновой кислоты (map00590) в Clostridium acetobutylicum ATCC 824. Зеленым выделены ферменты, экспрессирующиеся в этом организмеДля рассмотрения метаболических путей в домене Археи был выбран организм Methanobrevibacter olleyae (Archaea; Euryarchaeota; Methanobacteria; Methanobacteriales; Methanobacteriaceae). В этом организме экспрессируются точно такие же ферменты, что и в предыдущем организме. Для рассмотрения метаболических путей в домене Эукариот, Viridiplantae был выбран организм Zea mays ( Eukaryota; Viridiplantae; Streptophyta; Streptophytina; Embryophyta; Tracheophyta; Euphyllophyta; Spermatophyta; Magnoliophyta; Mesangiospermae; Liliopsida; Petrosaviidae; commelinids; Poales). На рисунке 3 зеленым цветом выделены ферменты — участники каскада АК, экспрессирующиеся в этом организме (COX-1, LOX).

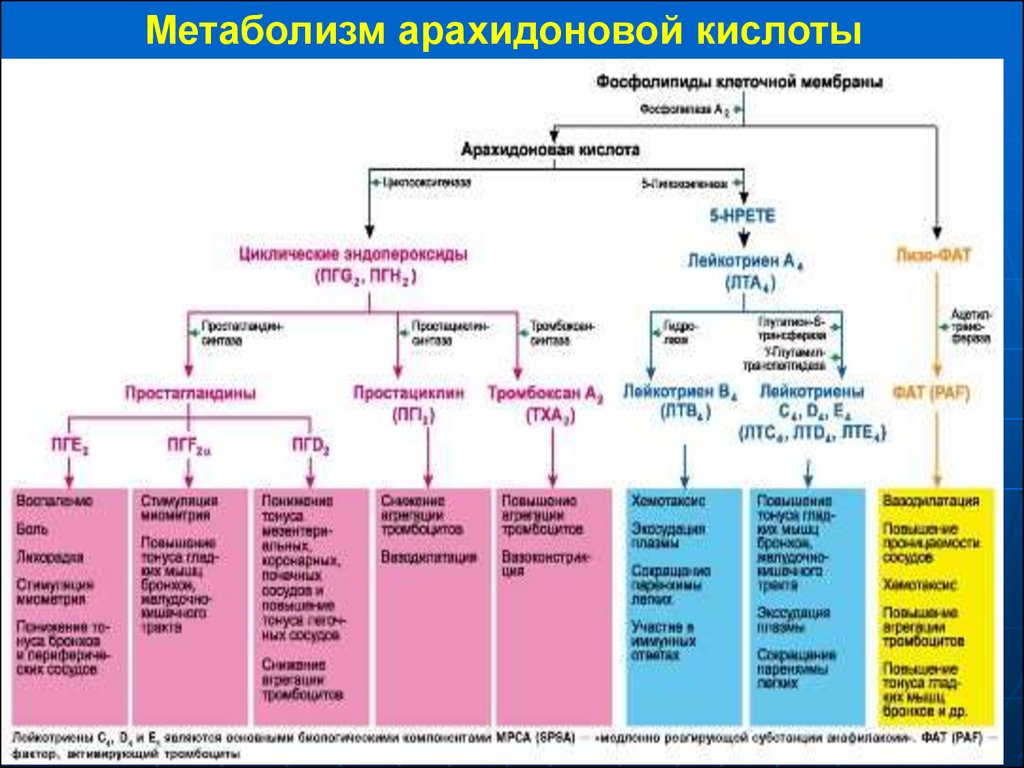 Рисунок 5. Каскад линолевой кислоты (map00591) в Felis catus. Зеленым выделены ферменты, экспрессирующиеся в этом организме
Рисунок 5. Каскад линолевой кислоты (map00591) в Felis catus. Зеленым выделены ферменты, экспрессирующиеся в этом организме3. Реакция окисления PGF2 в базе данных KEGG
На рисунке 6 представлена реакция (R02683) окисления простагландина F2 (C00639) до 15-кето-простагландина F2 (C05960). Ее осуществляет фермент 15-гидроксипростагландин дегидрогеназа [1.1.1.141]. Фермент принадлежит классу оксидоредуктаз. Донором электронов служит CH-OH группа, акцептором — NAD+ или NADP+.4. Источники
[1] https://ru.wikipedia.org/wiki/Арахидоновая_кислота[2] https://en.wikipedia.org/wiki/Lipoxin
[3] Kroetz D.L., Zeldin D.C. Cytochrome P450 pathways of arachidonic acid metabolism. // Curr. Opin. Lipidol. 2002. Vol. 13, № 3. P. 273–283.
Фармакологические эффекты
ИСТОРИЯ
Применение НПВС для лечения человека насчитывает несколько тысячелетий.
Цельс (1 век до н.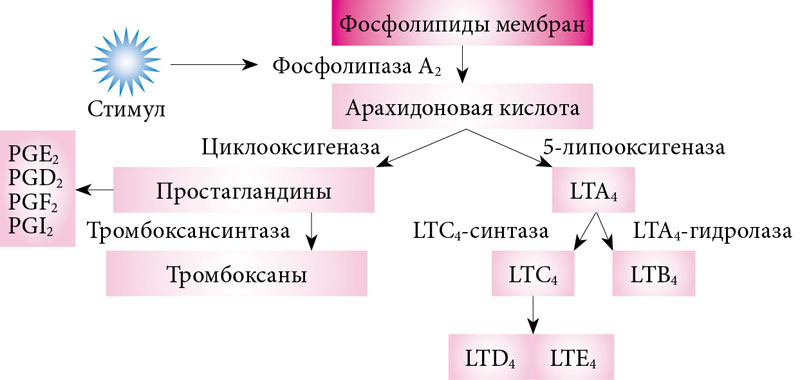 э.) описал 4 классических
признака воспаления:
э.) описал 4 классических
признака воспаления:
гиперемия, повышение температуры, боль, отек
и использовал экстракт коры ивы для облегчения этих симптомов.
Гиппократ рекомендовал сок коры ивы для уменьшения болей при родах и лечении лихорадки.
В 1827 г. из коры ивы был выделен гликозид салицин.
В 1869 г. сотрудник компании «Bayer» (Германия) Феликс Хофман синтезировал ацетилсалициловую кислоту
(по просьбе отца, страдающего тяжелым ревматизмом) с более приемлемым вкусом, чем чрезвычайно горький экстракт коры ивы.
В 1899 г. компания Bayer начала коммерческое производство аспирина.
В настоящее время насчитывается более 80 нестероидных противовоспалительных препаратов
Препараты
получили общее название нестероидные
противовоспалительные, поскольку
отличаются от стероидных противовоспалительных
глюкокортикоидов по химическим свойствам
и механизму действия.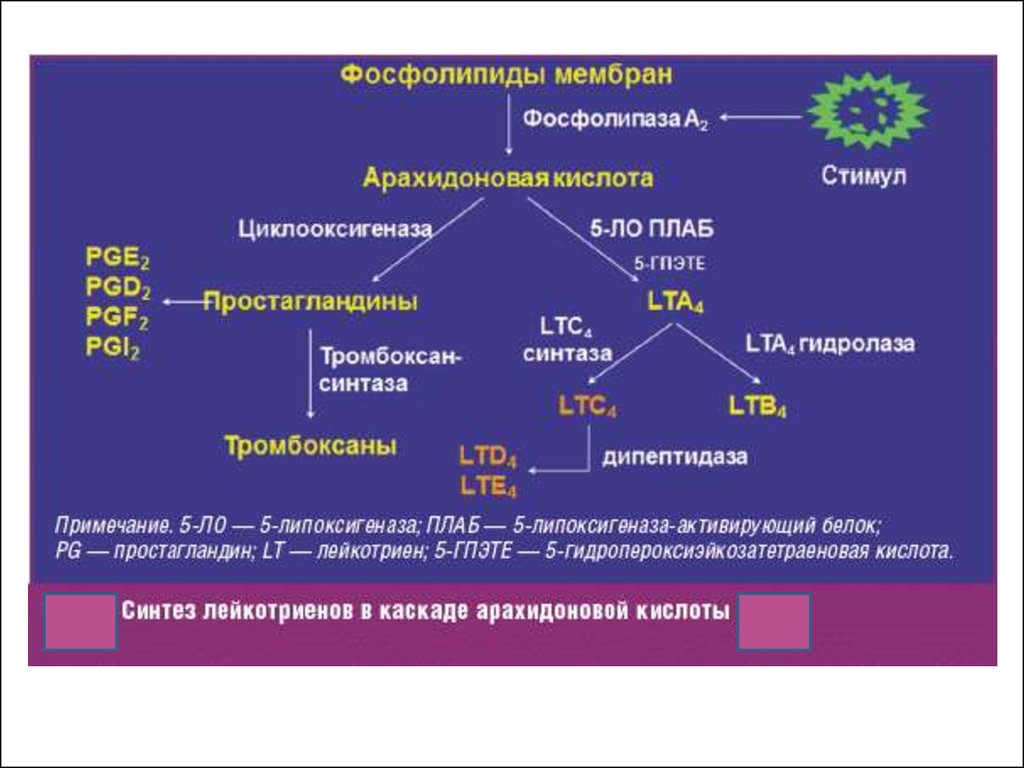
Ежегодно в мире НПВС принимают более 300 миллионов человек,
из них 200 миллионов приобретают препараты без рецепта врача.
30 млн. человек вынуждены принимать их постоянно
ВОСПАЛЕНИЕ
Основные компоненты воспаления
-альтерация,
-гиперемия,
-экссудация
-пролиферация.
Совокупность этих явлений лежит в основе местных признаков воспаления:
-покраснение,
-повышение температуры,
-отёк,
-боль,
-нарушение функции.
В результате генерализации процесса наряду с местными изменениями развиваются и общие
-интоксикация,
-лихорадка,
-лейкоцитоз,
-реакция
иммунной системы.
По характеру течения воспаление может быть острым и хроническим.
Острое воспалениедлится от нескольких дней до нескольких недель.
Для него характерны:
-яркая выраженность признаков воспаления и
-преобладание либо альтерации, либо сосудисто-экссудативных явлений.
Хроническое воспаление– это более вялый, длительно текущий процесс.
Преобладают:
-дистрофические и
-пролиферативные явления.
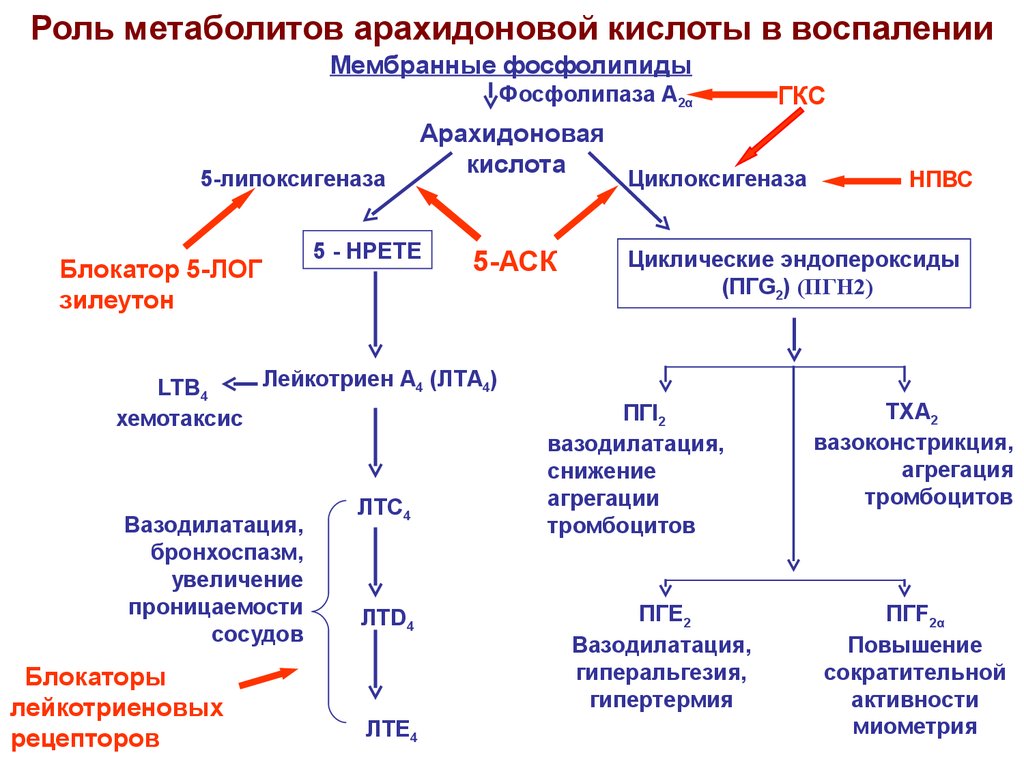
В процессе воспаления под влиянием различных повреждающих факторов
(микробы, их токсины, ферменты лизосом, гормоны)
включается «каскад» арахидоновой кислоты
(при воспалении высвобождается
арахидоновая кислота из мембранных
фосфолипидов).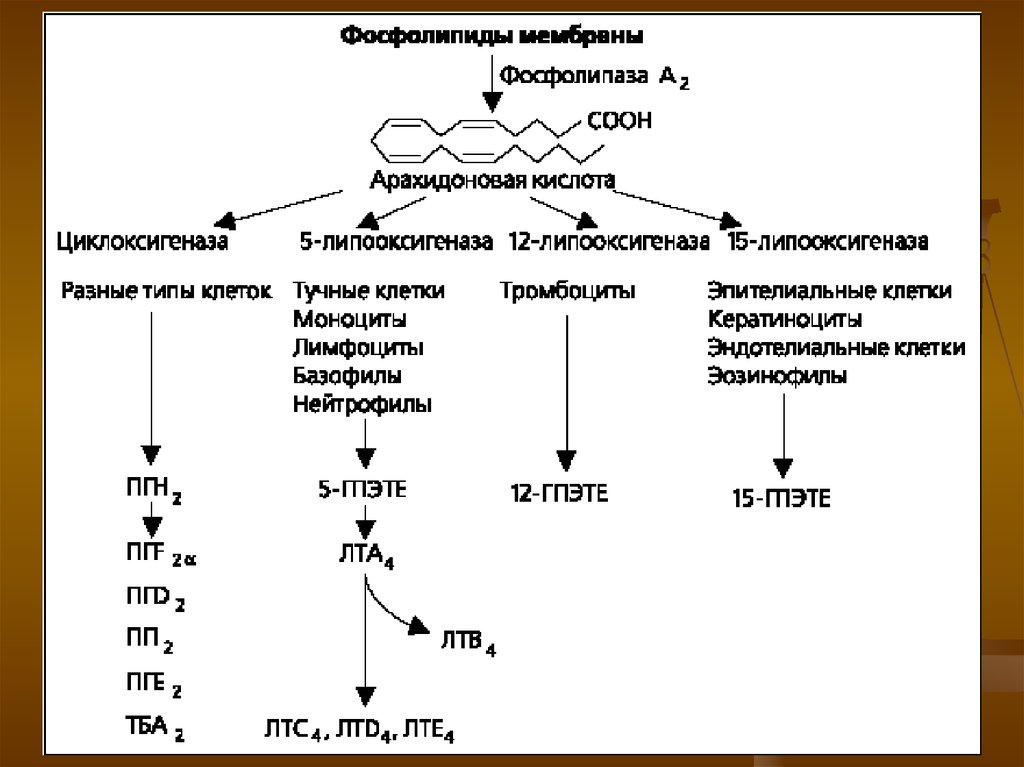
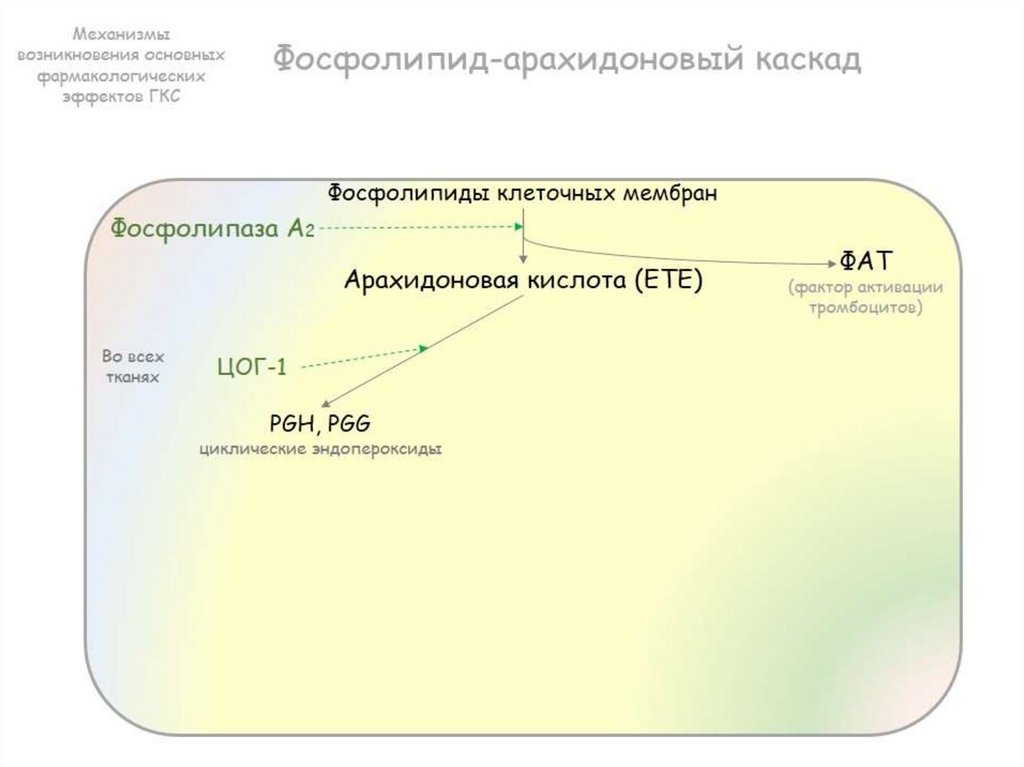
1) активируется фосфолипаза А2,
которая из фосфолипидов клеточных мембран освобождает арахидоновую кислоту.
Арахидоновая кислота — предшественник простагландинов (ПГ) – медиаторов воспаления.
2)Простагландины
в очаге воспаления принимают участие в развитии
-вазодилатации,
-гиперемии,
-лихорадки.
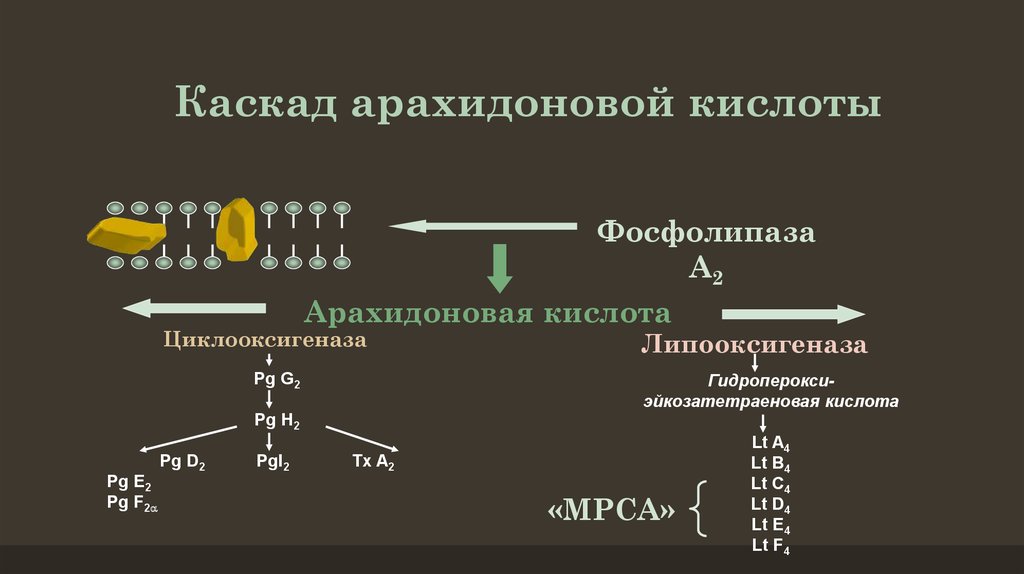
3)Арахидоновая кислота вовлекается в процесс метаболизма:
циклооксигеназный и липооксигеназный.
При участии циклооксигеназы арахидоновая кислота превращается в медиаторы воспаления
-циклические эндопероксиды1
-простагландины2
-простациклины
-тромбоксаны 3
При участии липооксигеназы
-арахидоновая кислота превращается в лейкотриены —
медиаторы
аллергических реакций немедленного
типа и медиаторы воспаления.
Циклооксигеназа (ЦОГ) — ключевой фермент метаболизма арахидоновой кислоты.
Этот фермент катализирует две независимые реакции:
1) циклооксигеназную
присоединение молекулы кислорода к молекуле арахидоновой кислоты с образованием ПГG2
2) пероксидазную — приводит к конверсии ПГG2 в более стабильный ПГН2
1Синтез эндопероксидов, простагландинов и лейкотриенов сопровождается
появлением свободных радикалов кислорода, способствующих
-развитию воспалительного процесса,
-повреждению клеток
-повреждению субклеточных структур
-возникновению болевых реакций
2Сами простагландины (Е1, I2) наиболее активные медиаторы воспаления
-повышают активность медиаторов воспаления и боли (гистамина,серотонина,брадикинина)
-расширяют артериолы
-увеличивают проницаемость капилляров
-участвуют в развитии отека и гиперемии
-участвуют в нарушении микроциркуляции
-участвуют в формировании болевых ощущений
3Простагландины F2 и тромбоксан А2
-вызывают сужение венул
Тромбоксан А2
-способствует образованию тромбов, усугубляющих нарушения микроциркуляции
Простагландиновые рецепторы расположены
-на мембранах клеток в периферических тканях
-на окончаниях чувствительных нервов
-в ЦНС
Большинство
простагландиновых рецепторов выполняет
активирующую функцию.
Усиление образования простагландинов в ЦНС (локальное) облегчает проведение болевых импульсов, приводит к гипералгезии, повышению температуры тела.
ОСНОВНОЙ МЕХАНИЗМ ДЕЙСТВИЯ НПВС
Расшифровали в 1971 г. Вэйн, Смит.
В основе– угнетающее влияние на биосинтез простагландинов.
НПВС вызывают
-блок или
-ингибирование перехода циклооксигеназы в активный фермент.
В результате резко уменьшается образование провоспалительных ПГ типов Е и F.
ПРОТИВОВОСПАЛИТЕЛЬНЫЙ
НПВС обладают противовоспалительным действием широкого спектра –
уменьшают проявления воспалительного процесса любой этиологии и любого характера течения.
Угнетают
-процессы экссудации при остром воспалении (выраженный эффект),
—пролиферативную активность фибробластов при хроническом
воспалении (умеренный эффект).
на процесс альтерации препараты влияют мало.
1) Подавление экссудативной фазы связано с
-блокадой циклооксигеназы
-торможением синтеза простагландинов (Е1, I2, F2), тромбоксана А2
Это приводит к уменьшению гиперемии, отека, боли.
Угнетение образования тромбоксана А2 и активности гиалуронидазы
Способствует нормализации микроциркуляции.
2) Подавление интенсивности пролиферативных процессов
Блокируя синтез простагландинов, препараты уменьшают проницаемость сосудистой стенки и проникновение в ткани плазменных факторов.
При этом снижается активность гуанилатциклазы и уровень цГМФ.
Угнетается деление фибробластов, синтез коллагена, мукополисахаридов,
образование
ревматических гранулем и соединительной
ткани.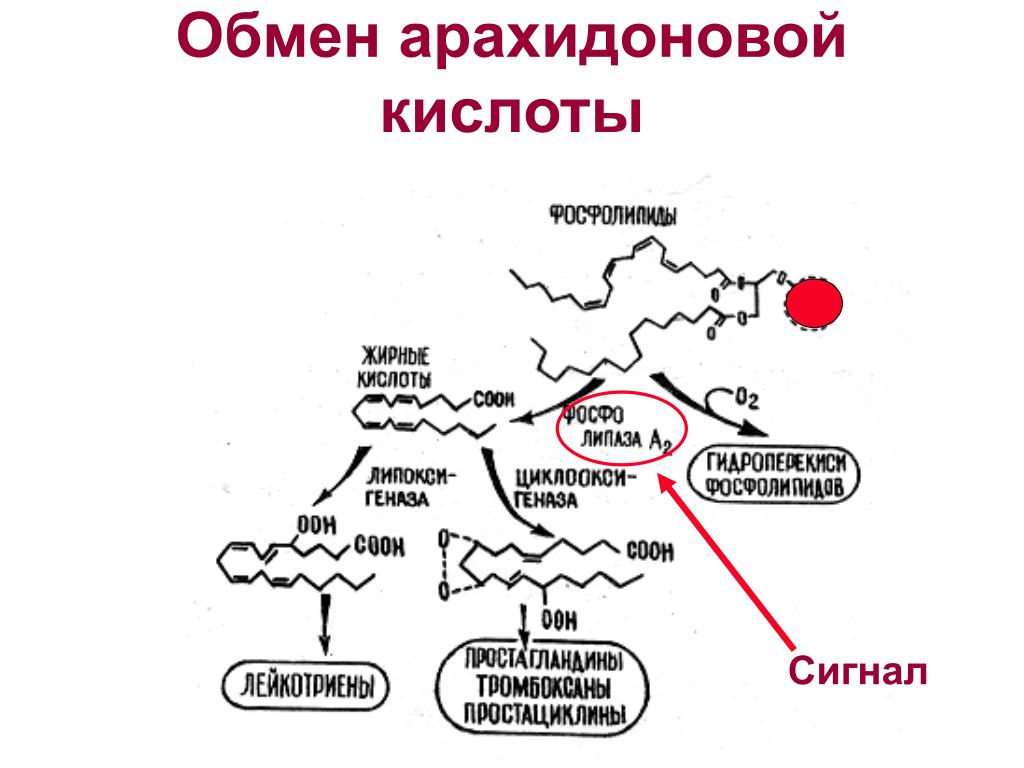
Антипролиферативное действие
частично связано и с торможением активности серотонина и брадикинина.
Особенности действия
1) Препараты не тормозят деструктивные процессы в хрящевой и костной ткани.
2) Подавляют способность хондроцитов секретировать ингибиторы «разрушающих» протеолитических ферментов (коллагеназы и эластазы).
Ферменты накапливаются, вызывая деструкцию хрящевой и костной ткани.
3) Снижается синтез протеинов, необходимых для регенерации хрящевой и костной ткани.
4) Подавляется гемоперфузия в очаге воспаления,
что также нарушает процесс регенерации, особенно в головках костей..
Только пироксикам не вызывает деструкции хряща и кости,
так
как блокирует интерлейкин-1, стимулирующий
продукцию «разрушающих» протеолитических
ферментов (коллагеназы и эластазы).
Максимальная выраженность противовоспалительного эффекта у пиразолонов (кроме анальгина и амидопирина) > салицилатов > производных индолуксусной кислоты > производных фенилуксусной кислоты > производных фенилпропионовой кислоты.
НПВС составляют
также группу неопиатных анальгетиков,
они эффективно подавляют слабую боль
и боль умеренной интенсивности. По
активности они уступают наркотическим
(опиатным) анальгетикам и в большинстве
своем малоэффективны при боли висцерального
генеза или острой травматической боли,
но по сравнению с опиатами не вызывают
эйфории, угнетения дыхания, обстипации.
К ним не развивается привыкание,
пристрастие (зависимость) и они гораздо
более доступны. При боли воспалительного
генеза наиболее активные НПВС не уступают
по эффективности опиатным анальгетикам.
При необходимости, например, при
хронической упорной боли у онкологических
больных НПВС могут применяться
одновременно с опиатными анальгетиками,
потенцируя их эффект.
Ряд веществ, образующихся при повреждении тканей и воспалении, способны вызывать боль, возбуждая чувствительные нервные окончания. Данные медиаторы могут активировать сенсорный нерв напрямую (например, Н+, АТФ, глутамат, серотонин, гистамин, брадикинин), или сенсибилизировать нервное окончание к действию других факторов (простагландины и простациклин, ряд цитокинов, таких как интерлейкин-1β, интерлейкин-2, интерлейкин-6, фактор-α некроза опухоли и др.). Впрочем, в работе McQueenD.S. и соавторов (1991) было продемонстрировано не только сенсибилизирующее, но и прямое активирующее действие PGI2на высокопороговые механоноцицепторы в условиях ограниченного адъювант-вызванного моноартрита у собак. Болеутоляющий эффект НПВС во многом связан с противовоспалительным действием и обусловлен подавлением синтеза простагландинов как в очаге поражения, так и в ЦНС.
Механизм болеутоляющего действия НПВС складывается из 2-х компонентов:
периферического и центрального.
Каскад арахидоновой кислоты. Простагландины, тромбоксаны и лейкотриены
Обзор
. 8 июня 1984 г. Дополнение: S15-25. дои: 10.1007/BF00915709.Э Гранстрём
- PMID: 60
- DOI: 10.1007/BF00915709
Обзор
E Гранстрём. Воспаление. 1984 июнь
. 8 июня 1984 г. Дополнение: S15-25. дои: 10.1007/BF00915709.Автор
Э Гранстрем
- PMID: 60
- DOI:
10.
 1007/BF00915709
1007/BF00915709
Абстрактный
Некоторые полиненасыщенные жирные кислоты, такие как арахидоновая кислота, метаболизируются путем оксигенации в большое семейство биологически активных веществ, простаноидов. К ним относятся простагландины, тромбоксаны, простациклины, лейкотриены, а также ряд родственных соединений. Оксигенирование может происходить во многих различных положениях арахидоновой кислоты. Циклооксигеназа вводит кислород в положение C-11 и превращает полученное пероксисоединение в 9, 11-эндопероксидная структура. Образовавшиеся таким образом циклические пероксиды PGG2 и PGh3 являются сильнодействующими соединениями и являются непосредственными предшественниками простагландинов, тромбоксанов и простациклина. Другие ферменты, липоксигеназы, могут вместо этого вводить кислород в положения С-5, С-8, С-9, С-12 или С-15: дальнейшие превращения, например, из первоначально образованных 5- или 15-гидропероксикислот могут привести к к лейкотриенам.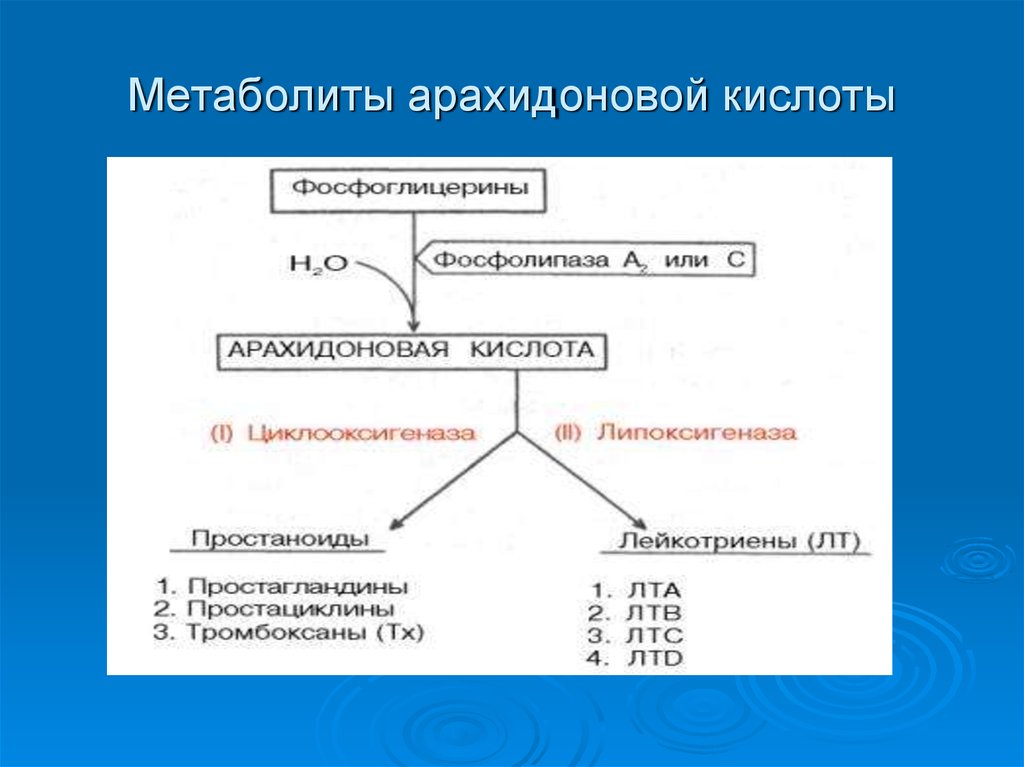 Простаноиды проявляют сильную и разнообразную биологическую активность и влияют на многочисленные процессы в организме. При некоторых патологических состояниях важную роль играют простаноиды. Например, некоторые продукты каскада арахидоновой кислоты считаются медиаторами воспалительной реакции: они образуются в процессе, способствуют симптомам эритемы, просачивания сосудов, лихорадки, боли и хемотаксиса, а угнетение их биосинтеза может быть достигается на разных уровнях противовоспалительными препаратами.
Простаноиды проявляют сильную и разнообразную биологическую активность и влияют на многочисленные процессы в организме. При некоторых патологических состояниях важную роль играют простаноиды. Например, некоторые продукты каскада арахидоновой кислоты считаются медиаторами воспалительной реакции: они образуются в процессе, способствуют симптомам эритемы, просачивания сосудов, лихорадки, боли и хемотаксиса, а угнетение их биосинтеза может быть достигается на разных уровнях противовоспалительными препаратами.
Похожие статьи
- Простагландины, тромбоксаны и лейкотриены при воспалении.
Мальмстен КЛ. Мальмстен КЛ. Am J Med. 1986 28 апреля; 80 (4B): 11-7. doi: 10.1016/0002-9343(86)
-2. Am J Med. 1986 год. PMID: 2871754 - Лейкотриены.
Хаммарстрём С.
 Хаммарстрем С.
Анну Рев Биохим. 1983; 52:355-77. doi: 10.1146/annurev.bi.52.070183.002035.
Анну Рев Биохим. 1983.
PMID: 6311078
Обзор.
Хаммарстрем С.
Анну Рев Биохим. 1983; 52:355-77. doi: 10.1146/annurev.bi.52.070183.002035.
Анну Рев Биохим. 1983.
PMID: 6311078
Обзор. - Синтез и метаболизм простагландинов, простациклина и тромбоксанов: каскад арахидоновой кислоты.
Ramwell PW, Foegh M, Loeb R, Leovey EM. Ramwell PW и др. Семин Перинатол. 1980 января; 4(1):3-13. Семин Перинатол. 1980. PMID: 6247764 Аннотация недоступна.
- Выяснение каскада арахидоновой кислоты. Открытие простагландинов, тромбоксана и лейкотриенов.
Самуэльссон Б. Самуэльсон Б. Наркотики. 1987; 33 Приложение 1:2-9. doi: 10.2165/00003495-198700331-00003. Наркотики. 1987. PMID: 3036460
- [Простагландины, тромбоксаны и лейкотриены.
 Их роль в сердечно-сосудистых заболеваниях, аллергических реакциях и воспалении.
Их роль в сердечно-сосудистых заболеваниях, аллергических реакциях и воспалении.Маклуф Дж., Боржеат П., Грейндж М.Дж., Вотье Дж.Л., Кан Дж.П. Маклуф Дж. и др. Пресс Мед. 1984 21 января; 13 (2): 91-6. Пресс Мед. 1984. PMID: 6320156 Обзор. Французский.
Посмотреть все похожие статьи
Цитируется
- На пути к нецелевому скринингу липидных биомаркеров для улучшения антидопинговых правил у лошадей.
Тоу К., Коули А., Боуэн С., Бишоп Д.П., Фу С. Тоу К. и др. Молекулы. 2022 30 декабря; 28 (1): 312. doi: 10.3390/молекулы28010312. Молекулы. 2022. PMID: 36615506 Бесплатная статья ЧВК. Обзор.
- Дигомо-γ-линоленовая кислота ингибирует рост ксенотрансплантата опухоли у мышей, несущих клетки HCA-7, трансфицированные кшРНК, нацеленные на дельта-5-десатуразу.

Сюй И, Ян С, Гао Д, Ян Л, Мискиминс К, Цянь СЫ. Сюй Ю и др. БМК Рак. 2018 19 декабря; 18 (1): 1268. doi: 10.1186/s12885-018-5185-9. БМК Рак. 2018. PMID: 30567534 Бесплатная статья ЧВК.
- Дигомо-γ-линоленовая кислота ингибирует рост ксенотрансплантатных опухолей у мышей, несущих клетки рака поджелудочной железы человека (BxPC-3), трансфицированных дельта-5-десатуразой shRNA.
Ян X, Сюй Y, Гао D, Ян L, Цянь SY. Ян X и др. Редокс Биол. 2019 янв; 20:236-246. doi: 10.1016/j.redox.2018.10.001. Epub 2018 15 октября. Редокс Биол. 2019. PMID: 30384258 Бесплатная статья ЧВК.
- Избавление от персистирующей пикорнавирусной инфекции связано с усилением проапоптотического и клеточного иммунного ответа.
Стенфельдт К.
 , Эшбаумер М., Смолига Г.Р., Родригес Л.Л., Чжу Дж., Арцт Дж.
Стенфельдт С. и соавт.
Научный представитель, 19 декабря 2017 г.;7(1):17800. doi: 10.1038/s41598-017-18112-4.
Научный представитель 2017.
PMID: 29259271
Бесплатная статья ЧВК.
, Эшбаумер М., Смолига Г.Р., Родригес Л.Л., Чжу Дж., Арцт Дж.
Стенфельдт С. и соавт.
Научный представитель, 19 декабря 2017 г.;7(1):17800. doi: 10.1038/s41598-017-18112-4.
Научный представитель 2017.
PMID: 29259271
Бесплатная статья ЧВК. - In Vitro и In Silico Антидиабетическая и противомикробная оценка компонентов из Kickxia ramosissima ( Nanorrhinum ramosissimum ).
Амин А., Тюэнтер Э., Фубер К., Икбал Дж., Кос П., Маес Л., Эксарху В., Аперс С., Питерс Л. Амин А и др. Фронт Фармакол. 2017 1 мая; 8:232. дои: 10.3389/fфар.2017.00232. Электронная коллекция 2017. Фронт Фармакол. 2017. PMID: 28507520 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Рекомендации
- Природа.
 1964 22 августа; 203: 839-41
—
пабмед
1964 22 августа; 203: 839-41
—
пабмед
- Природа.
- Липиды. 1979 янв; 14(1):30-8 — пабмед
- Простагландины. 1975 авг; 10 (2): 343-55 — пабмед
- Биохим Биофиз Акта. 1968 22 октября; 164 (2): 426-9 — пабмед
- Proc Natl Acad Sci U S A.
 1976 May; 73(5):1730-4
—
пабмед
1976 May; 73(5):1730-4
—
пабмед
- Proc Natl Acad Sci U S A.
Типы публикаций
термины MeSH
вещества
Каскад арахидоновой кислоты в скелетных мышцах в норме и при воспалительных заболеваниях
Масталья Ф.Л., Гарлепп М.Дж., Филлипс Б.А. и Зилко П.Дж. Воспалительные миопатии: клинические, диагностические и терапевтические аспекты. Muscle Nerve 27 , 407–425 (2003).
ПабМед Google Scholar
Лундберг И.
 , Ульфгрен А.К., Ниберг П., Андерссон У. и Клареског Л. Производство цитокинов в мышечной ткани пациентов с идиопатическими воспалительными миопатиями. Ревматоидный артрит. 40 , 865–874 (1997).
, Ульфгрен А.К., Ниберг П., Андерссон У. и Клареског Л. Производство цитокинов в мышечной ткани пациентов с идиопатическими воспалительными миопатиями. Ревматоидный артрит. 40 , 865–874 (1997).КАС пабмед Google Scholar
Nyberg, P., Wikman, A.L., Nennesmo, I. & Lundberg, I. Повышенная экспрессия интерлейкина 1α и MHC класса I в мышечной ткани пациентов с хроническим неактивным полимиозитом и дерматомиозитом. J. Ревматология. 27 , 940–948 (2000).
КАС пабмед Google Scholar
Figarella-Branger, D., Civatte, M., Bartoli, C. & Pellissier, J. F. Цитокины, хемокины и молекулы клеточной адгезии при воспалительных миопатиях. Muscle Nerve 28 , 659–682 (2003).
КАС пабмед Google Scholar
Зонг М.
 и Лундберг И. Э. Патогенез, классификация и лечение воспалительных миопатий. Нац. Преподобный Ревматол. 7 , 297–306 (2011).
и Лундберг И. Э. Патогенез, классификация и лечение воспалительных миопатий. Нац. Преподобный Ревматол. 7 , 297–306 (2011).КАС пабмед Google Scholar
Nagaraju, K. & Lundberg, I.E. Полимиозит и дерматомиозит: патофизиология. Реум. Дис. клин. Север. Являюсь. 37 , 159–171 (2011).
ПабМед Google Scholar
Приск, В. и Хуард, Дж. Мышечные травмы и восстановление: роль простагландинов и воспаление. Гистол. Гистопатол. 18 , 1243–1256 (2003).
КАС пабмед Google Scholar
Sun, R., Ba, X., Cui, L., Xue, Y. & Zeng, X. Лейкотриен B4 регулирует пролиферацию и дифференцировку культивируемых миобластов крысы посредством пути BLT1. Мол. Ячейки 27 , 403–408 (2009).
КАС пабмед Google Scholar
Лоэлл, И.
 и др. . Активированный путь LTB4 в мышечной ткани больных полимиозитом или дерматомиозитом. Энн. Реум. Дис. 72 , 293–299 (2013).
и др. . Активированный путь LTB4 в мышечной ткани больных полимиозитом или дерматомиозитом. Энн. Реум. Дис. 72 , 293–299 (2013).КАС пабмед Google Scholar
Якобссон, П. Дж., Торен, С., Моргенштерн, Р. и Самуэльссон, Б. Идентификация синтазы простагландина Е человека: микросомального, глутатион-зависимого, индуцируемого фермента, представляющего собой потенциальную новую мишень для лекарств. Проц. Натл акад. науч. США 96 , 7220–7225 (1999).
КАС пабмед Google Scholar
Торен, С. и др. . Микросомальная простагландин Е-синтаза-1 человека: очистка, функциональная характеристика и определение проекционной структуры. Дж. Биол. хим. 278 , 22199–22209 (2003 г.).
КАС пабмед Google Scholar
Мураками М.
 и др. . Регуляция биосинтеза простагландина E2 с помощью индуцируемой ассоциированной с мембраной синтазы простагландина E2, которая действует совместно с циклооксигеназой-2. Дж. Биол. хим. 275 , 32783–32792 (2000).
и др. . Регуляция биосинтеза простагландина E2 с помощью индуцируемой ассоциированной с мембраной синтазы простагландина E2, которая действует совместно с циклооксигеназой-2. Дж. Биол. хим. 275 , 32783–32792 (2000).КАС пабмед Google Scholar
Мураками М. и др. . Продукция клеточного простагландина E2 мембраносвязанной простагландин E-синтазой-2 через циклооксигеназы-1 и -2. Дж. Биол. хим. 278 , 37937–37947 (2003 г.).
КАС пабмед Google Scholar
Таниока Т., Накатани Ю., Семмио Н., Мураками М. и Кудо И. Молекулярная идентификация цитозольной синтазы простагландина Е2, которая функционально связана с циклооксигеназой-1 в непосредственном биосинтезе простагландина Е2. Дж. Биол. хим. 275 , 32775–32782 (2000).
КАС пабмед Google Scholar
Берлин Т.
 , Кронестранд Р., Новак Дж., Зонненфельд Т. и Веннмальм А. Преобразование арахидоновой кислоты в простагландины в гомогенатах скелетных мышц и почек человека. Acta Physiol. Сканд. 106 , 441–445 (1979).
, Кронестранд Р., Новак Дж., Зонненфельд Т. и Веннмальм А. Преобразование арахидоновой кислоты в простагландины в гомогенатах скелетных мышц и почек человека. Acta Physiol. Сканд. 106 , 441–445 (1979).КАС пабмед Google Scholar
Новак, Дж. и др. . Биосинтез простагландинов в микросомах скелетных мышц и почек человека. Простагландины Лейкот. Мед. 11 , 269–279 (1983).
КАС пабмед Google Scholar
Карамузис М. и др. . Микродиализ in situ внутримышечного введения простагландина и тромбоксана при сокращении скелетных мышц человека. Acta Physiol. Сканд. 171 , 71–76 (2001).
КАС пабмед Google Scholar
Залин, Р. Дж. Роль гормонов и простаноидов в in vitro пролиферации и дифференцировке миобластов человека.
 Экспл. Сотовый рез. 172 , 265–281 (1987).
Экспл. Сотовый рез. 172 , 265–281 (1987).КАС пабмед Google Scholar
Отис Дж. С., Беркхолдер Т. Дж. и Павлат Г. К. Индуцированная растяжением пролиферация миобластов зависит от пути ЦОГ2. Экспл. Сотовый рез. 310 , 417–425 (2005).
КАС пабмед Google Scholar
McElligott, M.A., Chaung, L.Y., Baracos, V. & Gulve, E.A. Производство простагландинов в культурах миотрубочек. Влияние на белковый обмен. Биохим. J. 253 , 745–749 (1988).
КАС пабмед ПабМед Центральный Google Scholar
Bondesen, B.A., Jones, K.A., Glasgow, W.C. & Pavlath, G.K. Ингибирование миграции миобластов простациклином связано с усиленным слиянием клеток. FASEB J. 21 , 3338–3345 (2007).

КАС пабмед Google Scholar
Velica, P., Khanim, F.L. & Bunce, C.M. Простагландин D2 ингибирует миогенез C2C12. Мол.Селл. Эндокринол. 319 , 71–78 (2010).
КАС пабмед Google Scholar
Теста, М. и др. . Экспрессия и активность изоформ циклооксигеназы в скелетных мышцах и миокарде человека и грызунов. J. Appl. Физиол. 103 , 1412–1418 (2007).
КАС пабмед Google Scholar
Weinheimer, EM и др. . Упражнения с отягощениями и экспрессия циклооксигеназы (ЦОГ) в скелетных мышцах человека: последствия для препаратов, ингибирующих ЦОГ, и синтеза белка. утра. Дж. Физиол. Регул. интегр. Комп. Физиол. 292 , R2241–R2248 (2007 г.).
КАС пабмед Google Scholar
Студенкова, Дж.
 Т. и др. . Экспрессия циклооксигеназы-1, циклооксигеназы-2 и 5-липоксигеназы в воспаленной мышечной ткани больных полимиозитом и дерматомиозитом. клин. Эксп. Ревматол. 22 , 395–402 (2004).
Т. и др. . Экспрессия циклооксигеназы-1, циклооксигеназы-2 и 5-липоксигеназы в воспаленной мышечной ткани больных полимиозитом и дерматомиозитом. клин. Эксп. Ревматол. 22 , 395–402 (2004).КАС пабмед Google Scholar
Буфорд, Т. В. и др. . Влияние эксцентрических упражнений на беговой дорожке на экспрессию воспалительных генов в скелетных мышцах человека. Заявл. Физиол. Нутр. Метаб. 34 , 745–753 (2009).
КАС пабмед Google Scholar
Рабуэль, К. и др. . Септическая миопатия человека: индукция циклооксигеназы, гемоксигеназы и активация убиквитинового протеолитического пути. Анестезиология 101 , 583–590 (2004).
КАС пабмед Google Scholar
Судбо, Дж.
 и др. . Экспрессия ЦОГ-2 в поперечно-полосатых мышцах в физиологических условиях. Оральный дис. 9 , 313–316 (2003).
и др. . Экспрессия ЦОГ-2 в поперечно-полосатых мышцах в физиологических условиях. Оральный дис. 9 , 313–316 (2003).КАС пабмед Google Scholar
Короткова М. и др. . Влияние иммуносупрессивной терапии на микросомальную экспрессию простагландин Е-синтазы 1 и циклооксигеназ в мышечной ткани пациентов с полимиозитом или дерматомиозитом. Энн. Реум. Дис. 67 , 1596–1602 (2008).
КАС пабмед Google Scholar
Jansen, K.M. & Pavlath, G.K. Простагландин F2α способствует выживанию и росту мышечных клеток за счет активации ингибитора апоптозного белка BRUCE. Гибель клеток Отличие. 15 , 1619–1628 (2008).
КАС пабмед ПабМед Центральный Google Scholar
Horsley, V.
 & Pavlath, G.K. Простагландин F2α стимулирует рост клеток скелетных мышц посредством NFATC2-зависимого пути. Дж. Сотовый. биол. 161 , 111–118 (2003).
& Pavlath, G.K. Простагландин F2α стимулирует рост клеток скелетных мышц посредством NFATC2-зависимого пути. Дж. Сотовый. биол. 161 , 111–118 (2003).КАС пабмед ПабМед Центральный Google Scholar
Markworth, J. F. & Cameron-Smith, D. Простагландин F2α стимулирует передачу сигналов PI3K/ERK/mTOR и гипертрофию скелетных мышечных трубок. утра. Дж. Физиол. Клеточная физиол. 300 , C671–C682 (2011 г.).
КАС пабмед Google Scholar
Шен В., Приск В. Р., Ли Ю., Фостер В. и Хуард Дж. Ингибирование заживления скелетных мышц у мышей с дефицитом гена циклооксигеназы-2: роль PGE2 и PGF2α. J. Appl. Физиол. 101 , 1215–1221 (2006).
КАС пабмед Google Scholar
Мо, К., Ромеро-Суарес, С.
 , Боневальд, Л., Джонсон, М. и Бротто, М. Простагландин Е2: от клинического применения до его потенциальной роли в перекрестных помехах между костями и мышцами и миогенной дифференциации. Недавний патент. Биотехнолог. 6 , 223–229 (2012).
, Боневальд, Л., Джонсон, М. и Бротто, М. Простагландин Е2: от клинического применения до его потенциальной роли в перекрестных помехах между костями и мышцами и миогенной дифференциации. Недавний патент. Биотехнолог. 6 , 223–229 (2012).КАС пабмед ПабМед Центральный Google Scholar
Хантер, Дж. Г., ван Делфт, М. Ф., Рачубински, Р. А. и Капоне, Дж. П. Гамма-лиганды рецептора, активируемого пролифератором пероксисом, по-разному модулируют дифференцировку мышечных клеток и экспрессию гена MyoD через гамма-зависимый и независимый пути рецептора, активируемого пролифератором пероксисом. Дж. Биол. хим. 276 , 38297–38306 (2001).
КАС пабмед Google Scholar
Markworth, J. F. & Cameron-Smith, D. Добавка арахидоновой кислоты усиливает in vitro рост клеток скелетных мышц посредством ЦОГ-2-зависимого пути.
 утра. Дж. Физиол. Клеточная физиол. 304 , C56–C67 (2013).
утра. Дж. Физиол. Клеточная физиол. 304 , C56–C67 (2013).КАС пабмед Google Scholar
Mendias, C.L., Tatsumi, R. & Allen, R.E. Роль циклооксигеназы-1 и -2 в пролиферации, дифференцировке и слиянии сателлитных клеток. Muscle Nerve 30 , 497–500 (2004).
КАС пабмед Google Scholar
Бондесен, Б. А., Миллс, С. Т., Кегли, К. М. и Павлат, Г. К. Путь ЦОГ-2 необходим на ранних стадиях регенерации скелетных мышц. утра. Дж. Физиол. Клеточная физиол. 287 , C475–C483 (2004 г.).
КАС пабмед Google Scholar
Bondesen, B. A., Mills, S. T. & Pavlath, G. K. Путь ЦОГ-2 регулирует рост атрофированных мышц с помощью нескольких механизмов. утра. Дж. Физиол. Клеточная физиол. 290 , 1651–1659 (2006).

Google Scholar
Трапп, Т. А., Флаки, Дж. Д., Уайт, Ф., Ламберт, С. П. и Эванс, В. Дж. Скелетные мышцы PGF2α и PGE2 в ответ на эксцентрические упражнения с отягощениями: влияние ибупрофена и ацетаминофена. Дж. Клин. Эндокринол. Метаб. 86 , 5067–5070 (2001).
КАС пабмед Google Scholar
Миккельсен, У. Р. и др. . Местное введение НПВП не влияет на синтез белка и экспрессию генов в мышцах человека после эксцентрических упражнений. Скан. Дж. Мед. науч. Спорт 21 , 630–644 (2011).
КАС пабмед Google Scholar
Ридс, П. Дж. и Палмер, Р. М. Изменения высвобождения простагландинов, связанные с ингибированием синтеза мышечного белка дексаметазоном. Биохим. J. 219 , 953–957 (1984).

КАС пабмед ПабМед Центральный Google Scholar
Southorn, B.G. & Palmer, R.M. Ингибиторы фосфолипазы A2 блокируют стимуляцию синтеза белка инсулином в миобластах L6. Биохим. J. 270 , 737–739 (1990).
КАС пабмед ПабМед Центральный Google Scholar
Chromiak, J. A. & Vandenburgh, H. H. Механическая стимуляция клеток скелетных мышц смягчает вызванное глюкокортикоидами снижение продукции простагландина и активности простагландинсинтазы. Дж. Сотовый. Физиол. 159 , 407–414 (1994).
КАС пабмед Google Scholar
Kreiner, F. & Galbo, H. Повышенные мышечные интерстициальные уровни вызывающих боль веществ в симптоматических мышцах у пациентов с ревматической полимиалгией. Боль 152 , 1127–1132 (2011).

КАС пабмед Google Scholar
Саймонс, Дж. Д., Теодосси, С. Дж., Лонгхерст, Дж. К. и Стеббинс, С. Л. Внутримышечное накопление простагландинов во время статического сокращения трехглавой мышцы голени кошки. J. Appl. Физиол. 71 , 1837–1842 (1991).
КАС пабмед Google Scholar
Уилсон, Дж. Р. и Капур, С. К. Вклад простагландинов в расширение сосудов, вызванное физической нагрузкой, у людей. утра. Дж. Физиол. 265 , h271–h275 (1993 г.).
КАС пабмед Google Scholar
Янг, М. К., Бочек, Р. М., Херрингтон, П. Т. и Битти, С. Х. Старение: влияние на выработку простагландинов скелетными мышцами самцов макак-резусов (Macaca mulatta). мех. Старение Дев. 16 , 345–353 (1981).
КАС пабмед Google Scholar
Козловский Н.
 , Шохами Э. и Башан Н. Повышение активности PLA2 не связано с увеличением экспрессии GLUT1 в мышечных трубках L6 в условиях гипоксии. Простагландины Лейкот. Сущность. Жирные кислоты 56 , 17–22 (1997).
, Шохами Э. и Башан Н. Повышение активности PLA2 не связано с увеличением экспрессии GLUT1 в мышечных трубках L6 в условиях гипоксии. Простагландины Лейкот. Сущность. Жирные кислоты 56 , 17–22 (1997).КАС пабмед Google Scholar
Макардл А., Эдвардс Р. Х. и Джексон М. Дж. Высвобождение креатинкиназы и простагландина Е2 из регенерирующих волокон скелетных мышц. J. Appl. Физиол. 76 , 1274–1278 (1994).
КАС пабмед Google Scholar
Briolay, A., Jaafar, R., Nemoz, G. & Bessueille, L. Миогенная дифференцировка и липидный состав клеток скелетных мышц L6 модулируются ПНЖК. Биохим. Биофиз. Acta 1828 , 602–613 (2012).
ПабМед Google Scholar
Hurley, M.S., Flux, C., Salter, A.M. & Brameld, J.
 M. Влияние жирных кислот на дифференцировку клеток скелетных мышц in vitro . Бр. Дж. Нутр. 95 , 623–630 (2006).
M. Влияние жирных кислот на дифференцировку клеток скелетных мышц in vitro . Бр. Дж. Нутр. 95 , 623–630 (2006).КАС пабмед Google Scholar
Lee, J.H., Tachibana, H., Morinaga, Y., Fujimura, Y. & Yamada, K. Модуляция пролиферации и дифференцировки клеток скелетных мышц C2C12 жирными кислотами. Науки о жизни. 84 , 415–420 (2009).
КАС пабмед Google Scholar
Кадотани А., Цучия Ю., Хатакеяма Х., Катагири Х. и Канзаки М. Различное влияние насыщенных и ненасыщенных свободных жирных кислот на экспрессию ЦОГ-2 в миотрубках C2C12. утра. Дж. Физиол. Эндокринол. Метаб. 297 , E1291–E1303 (2009 г.).
КАС пабмед Google Scholar
Макардл, А., Фоксли, А., Эдвардс, Р. Х. и Джексон, М.
 Дж. Метаболизм простагландинов в мышцах мышей MDX с дефицитом дистрофина. Биохим. соц. Транс. 19 , 177С (1991).
Дж. Метаболизм простагландинов в мышцах мышей MDX с дефицитом дистрофина. Биохим. соц. Транс. 19 , 177С (1991).КАС пабмед Google Scholar
Джексон М.Дж., Брук М.Х., Кайзер К. и Эдвардс Р.Х. Высвобождение креатинкиназы и простагландина Е2 из изолированной мышцы Дюшенна. Неврология 41 , 101–104 (1991).
КАС пабмед Google Scholar
Линдал М., Бэкман Э., Хенрикссон К.Г., Гороспе Дж.Р. и Хоффман Э.П. Активность фосфолипазы А2 при дистрофинопатиях. Нервно-мышечная. Беспорядок. 5 , 193–199 (1995).
КАС пабмед Google Scholar
Окинага, Т. и др. . Индукция гемопоэтической простагландин-D-синтазы в гиалинизированных некротических мышечных волокнах: ее роль в групповом некрозе.
 Акта Нейропатол. 104 , 377–384 (2002).
Акта Нейропатол. 104 , 377–384 (2002).КАС пабмед Google Scholar
Мори, И. и др. . Ингибирование простагландин-D-синтазы подавляет мышечный некроз. утра. Дж. Патол. 174 , 1735–1744 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Туринский Дж., О’Салливан Д.М. и Бейли Б.П. Модуляция синтеза простагландина Е2 в скелетных мышцах крыс. утра. Дж. Физиол. 262 , E476–482 (1992).
КАС пабмед Google Scholar
Jaweed, M.M., Alam, I., Herbison, G.J. & Ditunno, J.F. Jr. Простагландины в денервированных скелетных мышцах крысы: эффект прямой электрической стимуляции. Неврология 6 , 2787–2792 (1981).
КАС пабмед Google Scholar
Turinsky, J.
 Фосфолипиды, простагландин E2 и протеолиз в денервированных мышцах. утра. Дж. Физиол. 251 , R165–R173 (1986).
Фосфолипиды, простагландин E2 и протеолиз в денервированных мышцах. утра. Дж. Физиол. 251 , R165–R173 (1986).КАС пабмед Google Scholar
Мюррей, М. А. и Роббинс, Н. Пролиферация клеток в денервированных мышцах: идентичность и происхождение делящихся клеток. Неврология 7 , 1823–1833 (1982).
КАС пабмед Google Scholar
Тегедер Л., Циммерманн Дж., Меллер С.Т. и Гайслингер Г. Высвобождение болеутоляющих веществ при экспериментальной мышечной боли у человека. Воспаление. Рез. 51 , 393–402 (2002).
КАС пабмед Google Scholar
Hedenberg-Agnusson, B., Ernberg, M., Alstergren, P. & Kopp, S. Опосредование боли простагландином E2 и лейкотриеном B4 в жевательной мышце человека.
 Акта Одонтол. Сканд. 59 , 348–355 (2001).
Акта Одонтол. Сканд. 59 , 348–355 (2001).Google Scholar
Rodemann, H.P. & Goldberg, A.L. Арахидоновая кислота, простагландин E2 и F2 альфа влияют на скорость обмена белков в скелетной и сердечной мышцах. Дж. Биол. хим. 257 , 1632–1638 (1982).
КАС пабмед Google Scholar
Родеманн, Х. П., Ваксман, Л. и Голдберг, А. Л. Стимуляция деградации белка в мышцах с помощью Ca 2+ опосредуется простагландином Е2 и не требует активируемой кальцием протеазы. Дж. Биол. хим. 257 , 8716–8723 (1982).
КАС пабмед Google Scholar
Barnett, JG & Ellis, S. Простагландин E2 и регуляция деградации белка в скелетных мышцах. Muscle Nerve 10 , 556–559 (1987).
КАС пабмед Google Scholar
Hasselgren, P.
 O., Zamir, O., James, J.H. & Fischer, J.E. Простагландин E2 не регулирует общий или миофибриллярный распад белка в инкубированных скелетных мышцах здоровых или септических крыс. Биохим. J. 270 , 45–50 (1990).
O., Zamir, O., James, J.H. & Fischer, J.E. Простагландин E2 не регулирует общий или миофибриллярный распад белка в инкубированных скелетных мышцах здоровых или септических крыс. Биохим. J. 270 , 45–50 (1990).КАС пабмед ПабМед Центральный Google Scholar
Рьё, И. и др. . Уменьшение слабовыраженного воспаления восстанавливает притупление постпрандиального мышечного анаболизма и ограничивает саркопению у старых крыс. J. Physiol. 587 , 5483–5492 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Гранадо, М., Мартин, А. И., Виллануа, М. А. и Лопес-Кальдерон, А. Экспериментальный артрит ингибирует ось инсулиноподобного фактора роста-I и вызывает истощение мышц за счет активации циклооксигеназы-2. утра. Дж. Физиол. Эндокринол. Метаб. 292 , E1656–E1665 (2007 г.
 ).
).КАС пабмед Google Scholar
Стрелков А.Б., Филдс А.Л. и Баракос В.Е. Влияние системного ингибирования продукции простагландинов на белковый обмен у крыс с опухолями. утра. Дж. Физиол. 257 , C261–C269 (1989).
КАС пабмед Google Scholar
McCarthy, D. O., Whitney, P., Hitt, A. & Al-Majid, S. Индометацин и ибупрофен сохраняют массу икроножных мышц у мышей с аденокарциномой толстой кишки-26. Рез. Нурс. Health 27 , 174–184 (2004).
ПабМед Google Scholar
Trappe, T.A., Standley, R.A., Jemiolo, B., Carroll, C.C. & Trappe, S.W. Участие простагландинов и миокинов в ингибирующих циклооксигеназу препаратах, усиливающих адаптацию скелетных мышц к упражнениям с отягощениями у пожилых людей. утра.
 Дж. Физиол. Регул. интегр. Комп. Физиол. 304 , Р198–Р205 (2013).
Дж. Физиол. Регул. интегр. Комп. Физиол. 304 , Р198–Р205 (2013).КАС пабмед Google Scholar
Standley, R.A., Liu, S.Z., Jemiolo, B., Trappe, S.W. & Trappe, T.A. Простагландин E2 индуцирует транскрипцию регуляторов массы скелетных мышц интерлейкина-6 и мышечного кольца RING-1 у людей. Простагландины Лейкот. Сущность. Жирные кислоты 88 , 361–364 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Баракос, В., Родеманн, Х. П., Динарелло, К. А. и Голдберг, А. Л. Стимуляция деградации мышечного белка и высвобождения простагландина Е2 лейкоцитарным пирогеном (интерлейкином-1). Механизм повышенной деградации мышечных белков при лихорадке. Н. англ. Дж. Мед. 308 , 553–558 (1983).
КАС пабмед Google Scholar
Шаферс, М.
 , Соркин, Л.С. и Соммер, К. Внутримышечная инъекция фактора некроза опухоли-альфа вызывает мышечную гипералгезию у крыс. Боль 104 , 579–588 (2003).
, Соркин, Л.С. и Соммер, К. Внутримышечная инъекция фактора некроза опухоли-альфа вызывает мышечную гипералгезию у крыс. Боль 104 , 579–588 (2003).КАС пабмед Google Scholar
Шнайдер, А. и др. . Ассоциированная с мембраной PGE-синтаза-1 (mPGES-1) коэкспрессируется как с ЦОГ-1, так и с ЦОГ-2 в почках. Почки, внутр. 65 , 1205–1213 (2004).
КАС пабмед Google Scholar
Буле, Л. и др. . Делеция микросомальной простагландин Е2 (PGE2) синтазы-1 снижает индуцибельную и базальную продукцию PGE2 и изменяет профиль простаноидов в желудке. Дж. Биол. хим. 279 , 23229–23237 (2004).
КАС пабмед Google Scholar
Лундберг И., Крац А.К., Александерсон Х. и Патарройо М.
 Снижение экспрессии интерлейкина-1альфа, интерлейкина-1бета и молекул клеточной адгезии в мышечной ткани после лечения кортикостероидами у пациентов с полимиозитом и дерматомиозитом. Ревматоидный артрит. 43 , 336–348 (2000).
Снижение экспрессии интерлейкина-1альфа, интерлейкина-1бета и молекул клеточной адгезии в мышечной ткани после лечения кортикостероидами у пациентов с полимиозитом и дерматомиозитом. Ревматоидный артрит. 43 , 336–348 (2000).КАС пабмед Google Scholar
Хеллиуэлл, П. С. и Джексон, С. Связь между слабостью и атрофией мышц при ревматоидном артрите. Энн. Реум. Dis 53 , 726–728 (1994).
КАС пабмед ПабМед Центральный Google Scholar
Стенстром, С. Х. и Минор, М. А. Доказательства пользы аэробных и укрепляющих упражнений при ревматоидном артрите. Ревматоидный артрит. 49 , 428–434 (2003).
ПабМед Google Scholar
Дональдсон А.В., Мэддокс М., Мартолини Д., Полки М.И. и Мэн В.
 Д. Функция мышц при ХОБЛ: комплексное взаимодействие. Междунар. Дж. Хрон. Препятствовать. Пульмон. Дис. 7 , 523–535 (2012).
Д. Функция мышц при ХОБЛ: комплексное взаимодействие. Междунар. Дж. Хрон. Препятствовать. Пульмон. Дис. 7 , 523–535 (2012).ПабМед ПабМед Центральный Google Scholar
Турессон, д. и др. . Повышенная эндотелиальная экспрессия HLA-DQ и интерлейкина 1α при внесуставном ревматоидном артрите. Результаты иммуногистохимического исследования скелетных мышц. Ревматология 40 , 1346–1354 (2001).
КАС пабмед Google Scholar
Бхаттачарья А. и др. . Генетическое удаление 12/15-липоксигеназы, но не 5-липоксигеназы, защищает от атрофии мышц, вызванной денервацией. Свободный радикал. биол. Мед. 67 , 30–40 (2013).
ПабМед Google Scholar
Янг, Дж. Ф., Хансен-Моллер, Дж. и Оксбьерг, Н.
 Влияние флавоноидов на стрессовые реакции в культурах миотрубочек. Дж. Агрик. Пищевая хим. 52 , 7158–7163 (2004).
Влияние флавоноидов на стрессовые реакции в культурах миотрубочек. Дж. Агрик. Пищевая хим. 52 , 7158–7163 (2004).КАС пабмед Google Scholar
Тагер, А. М. и др. . Рецептор лейкотриена B4 BLT1 опосредует раннее рекрутирование эффекторных Т-клеток. Нац. Иммунол. 4 , 982–990 (2003).
КАС пабмед Google Scholar
Liu, A., Claesson, H.E., Mahshid, Y., Klein, G. & Klein, E. Лейкотриен B4 активирует Т-клетки, которые ингибируют пролиферацию В-клеток в культурах мононуклеарных клеток, полученных из пуповинной крови, инфицированных ВЭБ. Кровь 111 , 2693–2703 (2008).
КАС пабмед Google Scholar
Чен, Х. и др. . Влияние лейкотриена B4 и простагландина E2 на дифференцировку мышиных регуляторных клеток Foxp3+ T и клеток Th27.

 1007/BF00915709
1007/BF00915709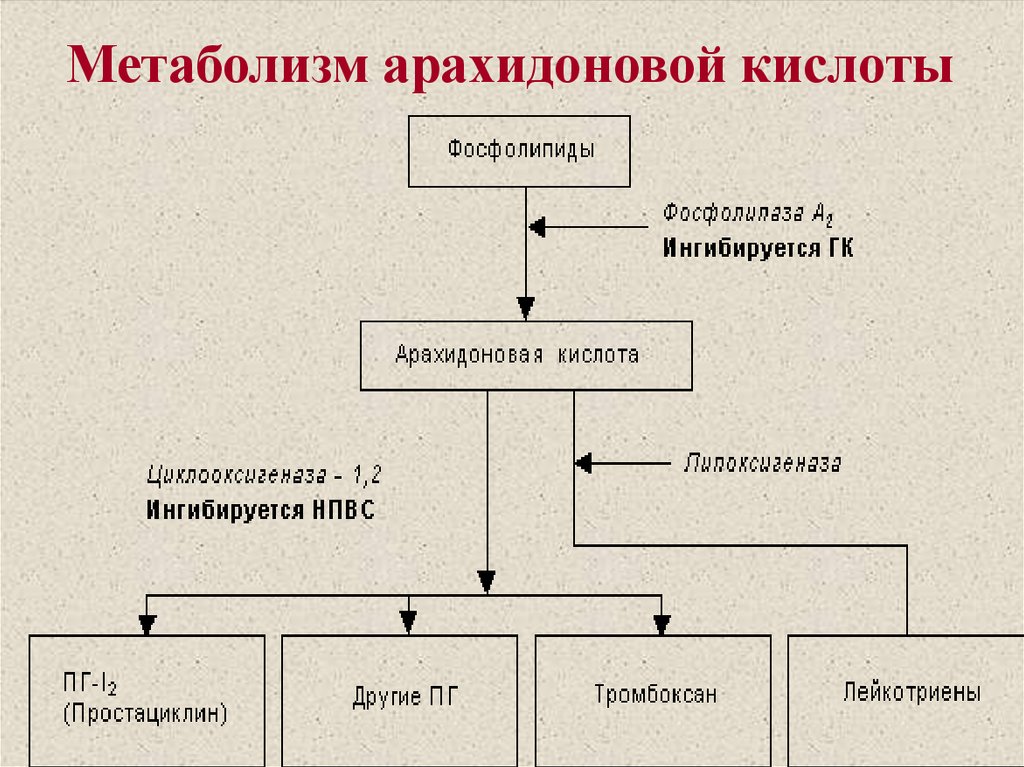 Хаммарстрем С.
Анну Рев Биохим. 1983; 52:355-77. doi: 10.1146/annurev.bi.52.070183.002035.
Анну Рев Биохим. 1983.
PMID: 6311078
Обзор.
Хаммарстрем С.
Анну Рев Биохим. 1983; 52:355-77. doi: 10.1146/annurev.bi.52.070183.002035.
Анну Рев Биохим. 1983.
PMID: 6311078
Обзор.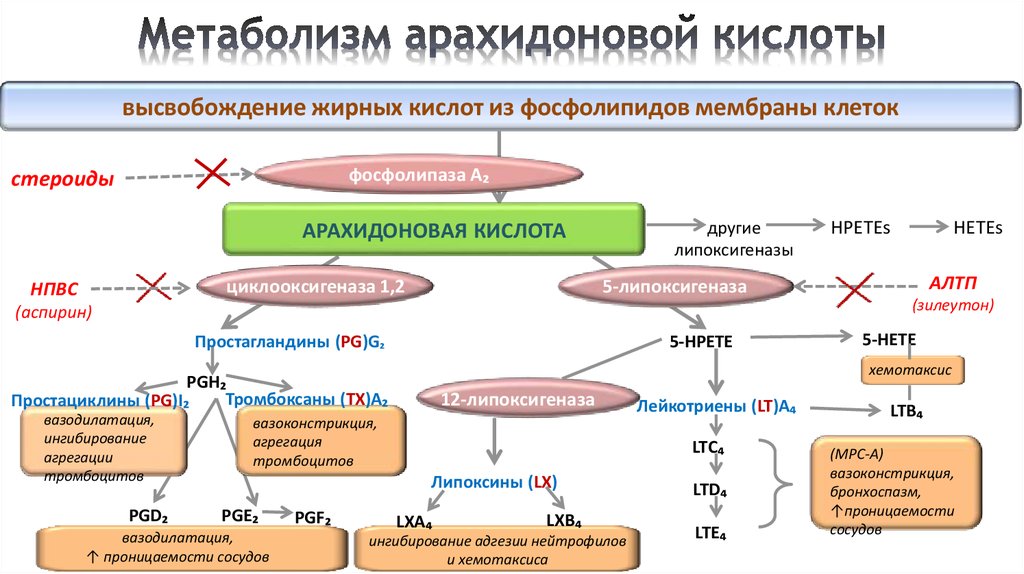 Их роль в сердечно-сосудистых заболеваниях, аллергических реакциях и воспалении.
Их роль в сердечно-сосудистых заболеваниях, аллергических реакциях и воспалении.
 , Эшбаумер М., Смолига Г.Р., Родригес Л.Л., Чжу Дж., Арцт Дж.
Стенфельдт С. и соавт.
Научный представитель, 19 декабря 2017 г.;7(1):17800. doi: 10.1038/s41598-017-18112-4.
Научный представитель 2017.
PMID: 29259271
Бесплатная статья ЧВК.
, Эшбаумер М., Смолига Г.Р., Родригес Л.Л., Чжу Дж., Арцт Дж.
Стенфельдт С. и соавт.
Научный представитель, 19 декабря 2017 г.;7(1):17800. doi: 10.1038/s41598-017-18112-4.
Научный представитель 2017.
PMID: 29259271
Бесплатная статья ЧВК.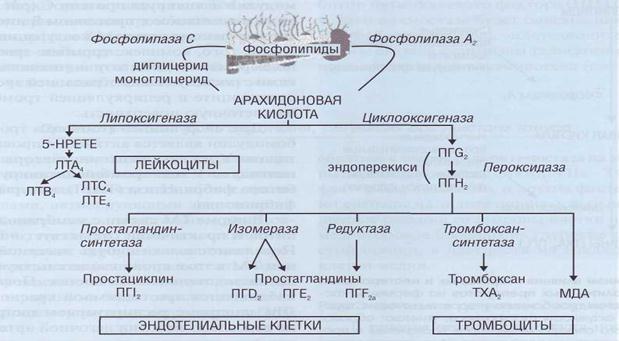 1964 22 августа; 203: 839-41
—
пабмед
1964 22 августа; 203: 839-41
—
пабмед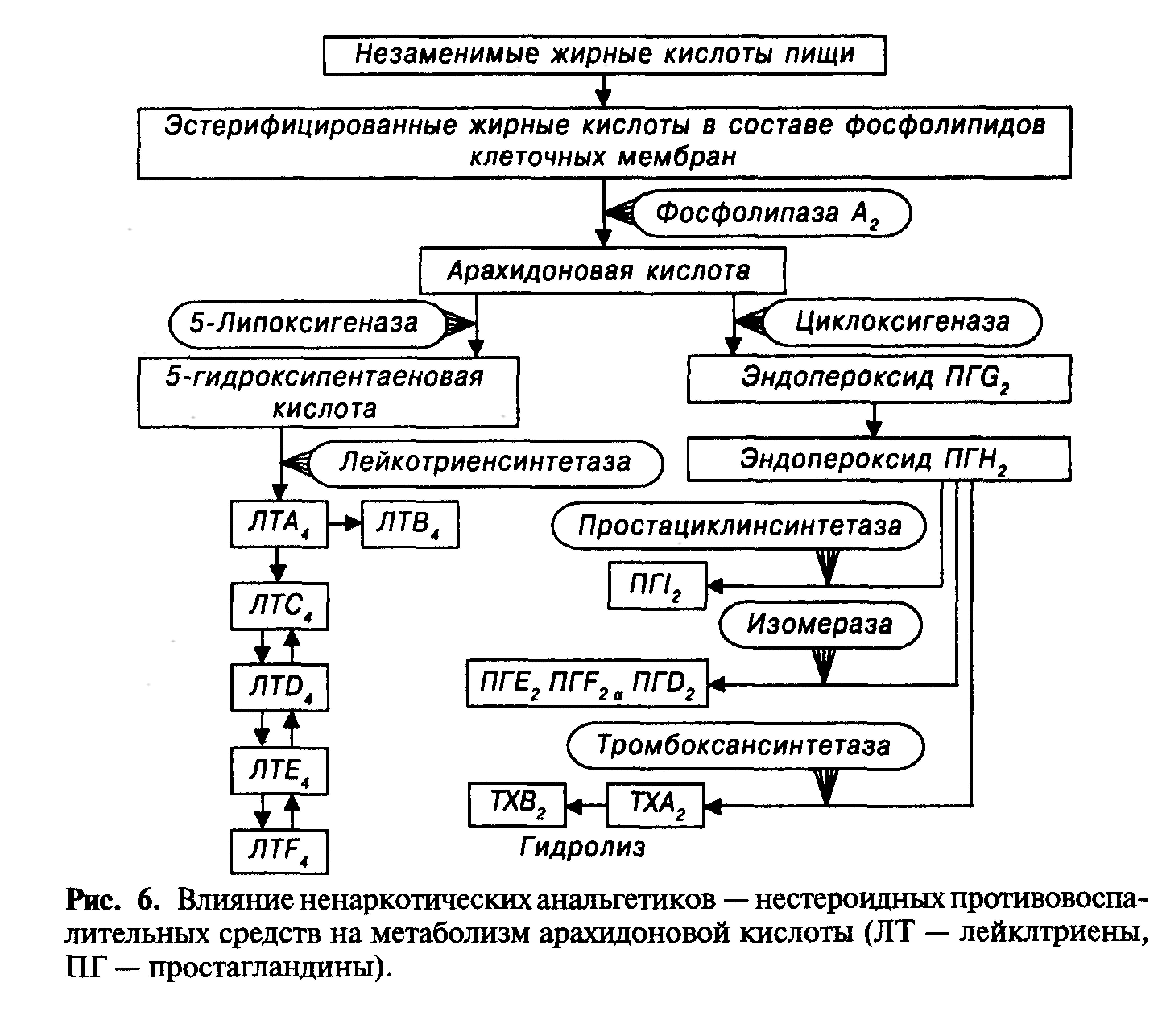 1976 May; 73(5):1730-4
—
пабмед
1976 May; 73(5):1730-4
—
пабмед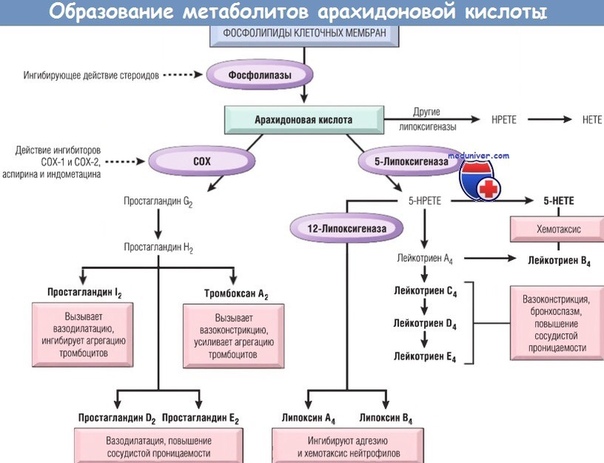 , Ульфгрен А.К., Ниберг П., Андерссон У. и Клареског Л. Производство цитокинов в мышечной ткани пациентов с идиопатическими воспалительными миопатиями. Ревматоидный артрит. 40 , 865–874 (1997).
, Ульфгрен А.К., Ниберг П., Андерссон У. и Клареског Л. Производство цитокинов в мышечной ткани пациентов с идиопатическими воспалительными миопатиями. Ревматоидный артрит. 40 , 865–874 (1997). и Лундберг И. Э. Патогенез, классификация и лечение воспалительных миопатий. Нац. Преподобный Ревматол. 7 , 297–306 (2011).
и Лундберг И. Э. Патогенез, классификация и лечение воспалительных миопатий. Нац. Преподобный Ревматол. 7 , 297–306 (2011). и др. . Активированный путь LTB4 в мышечной ткани больных полимиозитом или дерматомиозитом. Энн. Реум. Дис. 72 , 293–299 (2013).
и др. . Активированный путь LTB4 в мышечной ткани больных полимиозитом или дерматомиозитом. Энн. Реум. Дис. 72 , 293–299 (2013).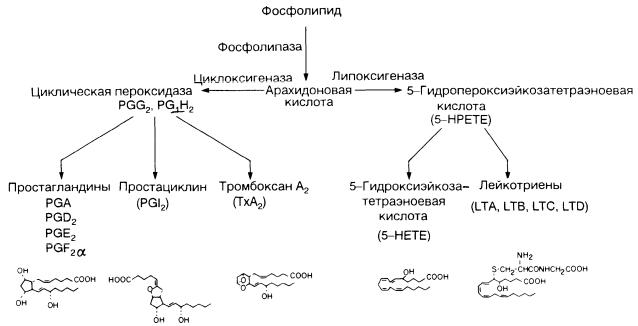 и др. . Регуляция биосинтеза простагландина E2 с помощью индуцируемой ассоциированной с мембраной синтазы простагландина E2, которая действует совместно с циклооксигеназой-2. Дж. Биол. хим. 275 , 32783–32792 (2000).
и др. . Регуляция биосинтеза простагландина E2 с помощью индуцируемой ассоциированной с мембраной синтазы простагландина E2, которая действует совместно с циклооксигеназой-2. Дж. Биол. хим. 275 , 32783–32792 (2000).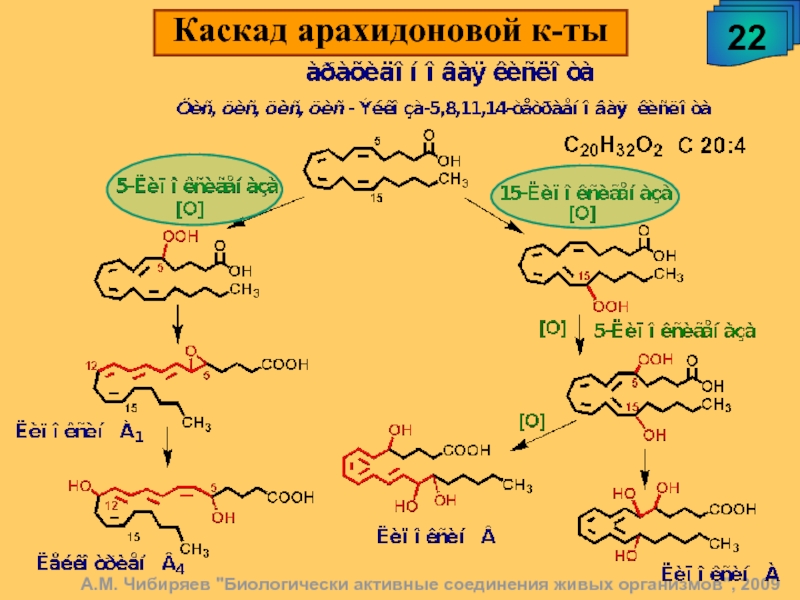 , Кронестранд Р., Новак Дж., Зонненфельд Т. и Веннмальм А. Преобразование арахидоновой кислоты в простагландины в гомогенатах скелетных мышц и почек человека. Acta Physiol. Сканд. 106 , 441–445 (1979).
, Кронестранд Р., Новак Дж., Зонненфельд Т. и Веннмальм А. Преобразование арахидоновой кислоты в простагландины в гомогенатах скелетных мышц и почек человека. Acta Physiol. Сканд. 106 , 441–445 (1979).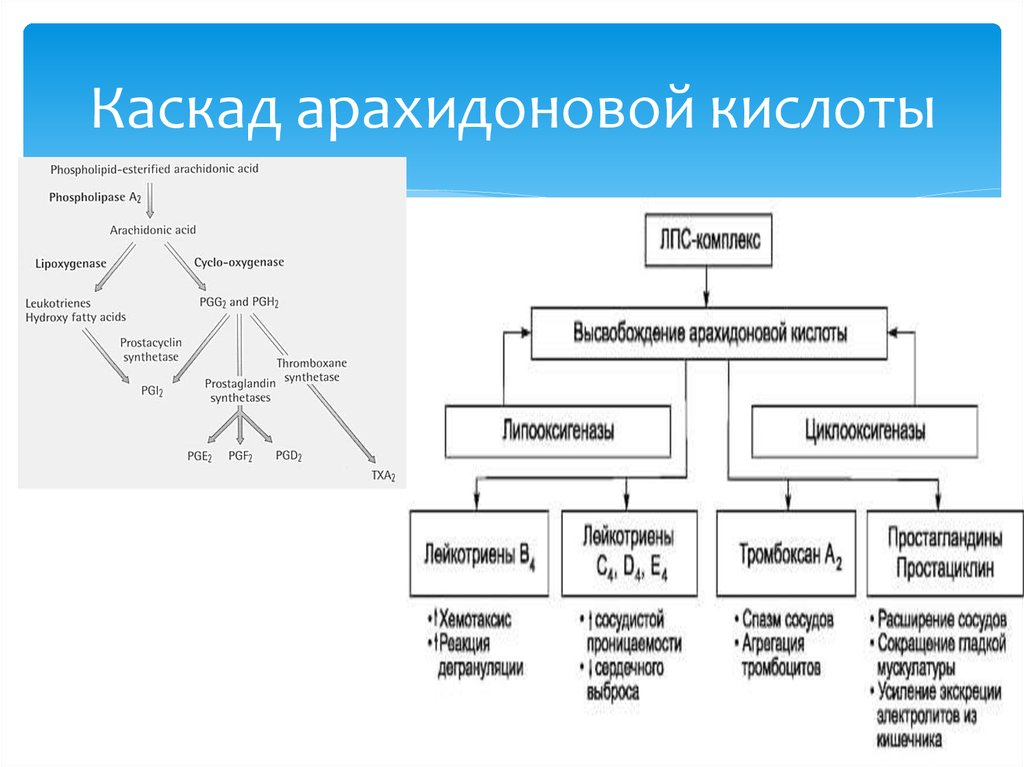 Экспл. Сотовый рез. 172 , 265–281 (1987).
Экспл. Сотовый рез. 172 , 265–281 (1987).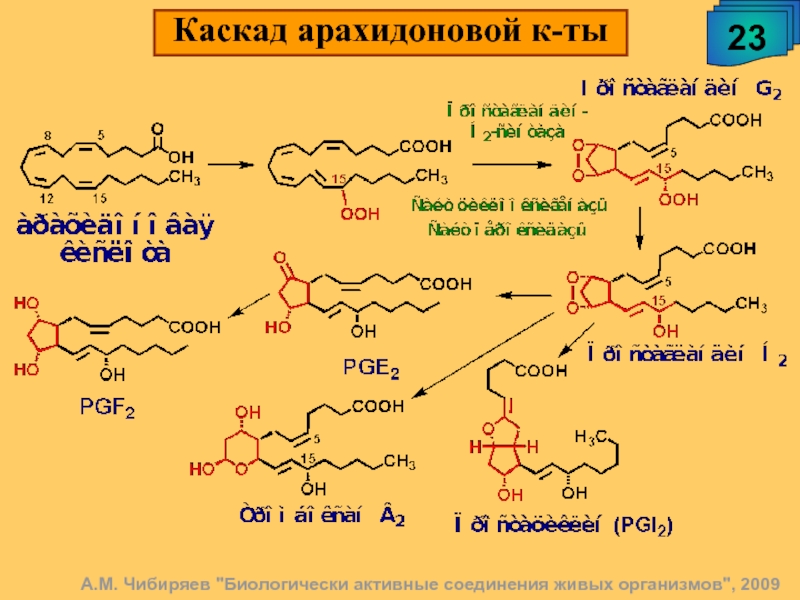
 Т. и др. . Экспрессия циклооксигеназы-1, циклооксигеназы-2 и 5-липоксигеназы в воспаленной мышечной ткани больных полимиозитом и дерматомиозитом. клин. Эксп. Ревматол. 22 , 395–402 (2004).
Т. и др. . Экспрессия циклооксигеназы-1, циклооксигеназы-2 и 5-липоксигеназы в воспаленной мышечной ткани больных полимиозитом и дерматомиозитом. клин. Эксп. Ревматол. 22 , 395–402 (2004).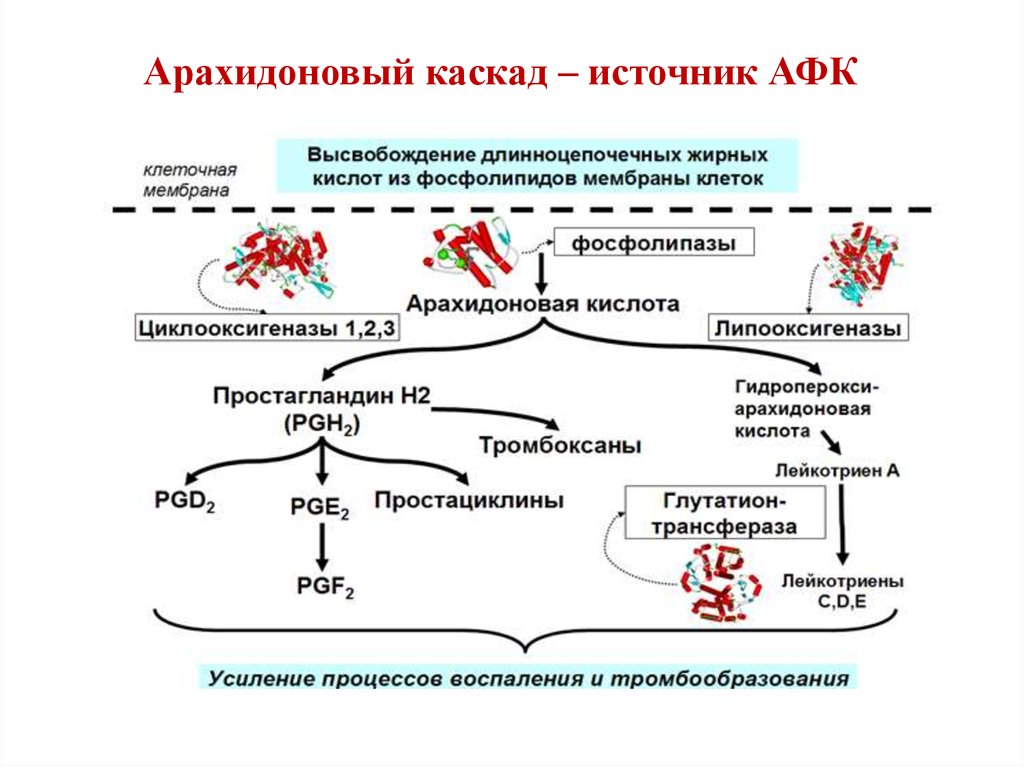 и др. . Экспрессия ЦОГ-2 в поперечно-полосатых мышцах в физиологических условиях. Оральный дис. 9 , 313–316 (2003).
и др. . Экспрессия ЦОГ-2 в поперечно-полосатых мышцах в физиологических условиях. Оральный дис. 9 , 313–316 (2003). & Pavlath, G.K. Простагландин F2α стимулирует рост клеток скелетных мышц посредством NFATC2-зависимого пути. Дж. Сотовый. биол. 161 , 111–118 (2003).
& Pavlath, G.K. Простагландин F2α стимулирует рост клеток скелетных мышц посредством NFATC2-зависимого пути. Дж. Сотовый. биол. 161 , 111–118 (2003).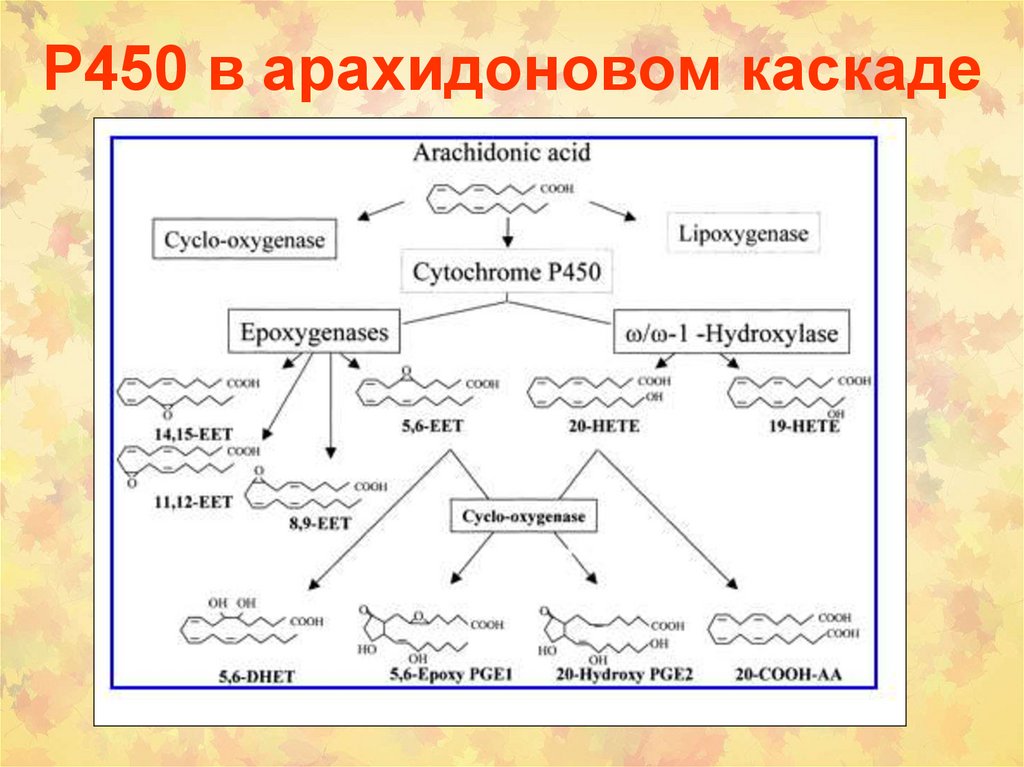 , Боневальд, Л., Джонсон, М. и Бротто, М. Простагландин Е2: от клинического применения до его потенциальной роли в перекрестных помехах между костями и мышцами и миогенной дифференциации. Недавний патент. Биотехнолог. 6 , 223–229 (2012).
, Боневальд, Л., Джонсон, М. и Бротто, М. Простагландин Е2: от клинического применения до его потенциальной роли в перекрестных помехах между костями и мышцами и миогенной дифференциации. Недавний патент. Биотехнолог. 6 , 223–229 (2012).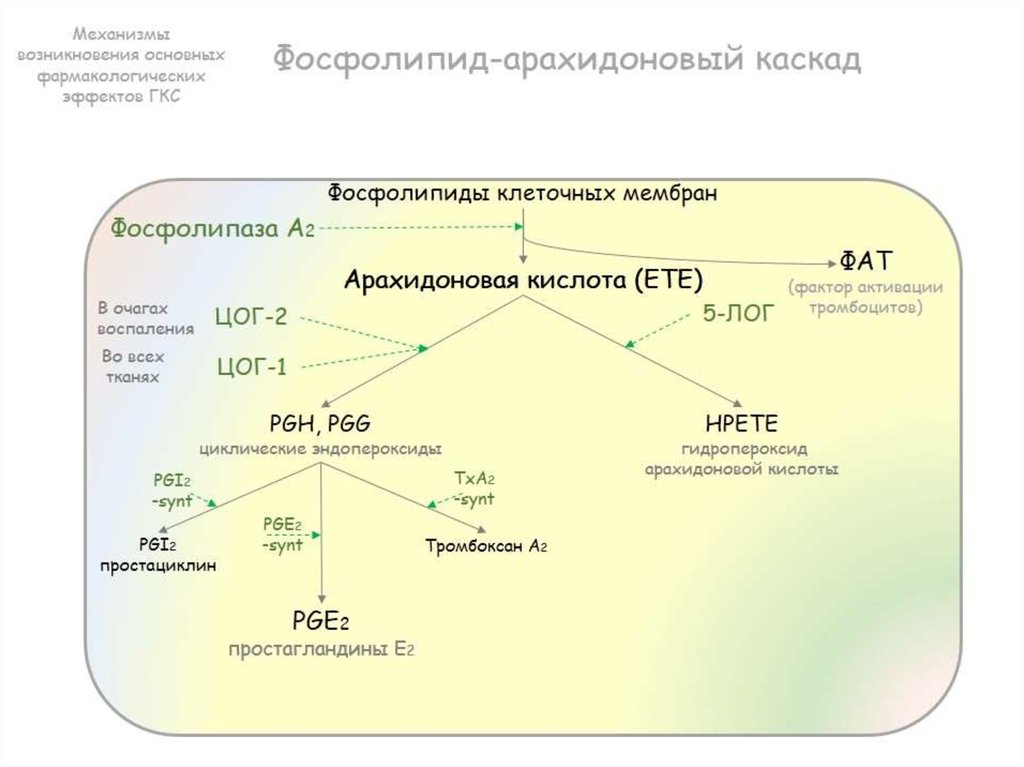 утра. Дж. Физиол. Клеточная физиол. 304 , C56–C67 (2013).
утра. Дж. Физиол. Клеточная физиол. 304 , C56–C67 (2013).
 , Шохами Э. и Башан Н. Повышение активности PLA2 не связано с увеличением экспрессии GLUT1 в мышечных трубках L6 в условиях гипоксии. Простагландины Лейкот. Сущность. Жирные кислоты 56 , 17–22 (1997).
, Шохами Э. и Башан Н. Повышение активности PLA2 не связано с увеличением экспрессии GLUT1 в мышечных трубках L6 в условиях гипоксии. Простагландины Лейкот. Сущность. Жирные кислоты 56 , 17–22 (1997). M. Влияние жирных кислот на дифференцировку клеток скелетных мышц in vitro . Бр. Дж. Нутр. 95 , 623–630 (2006).
M. Влияние жирных кислот на дифференцировку клеток скелетных мышц in vitro . Бр. Дж. Нутр. 95 , 623–630 (2006). Дж. Метаболизм простагландинов в мышцах мышей MDX с дефицитом дистрофина. Биохим. соц. Транс. 19 , 177С (1991).
Дж. Метаболизм простагландинов в мышцах мышей MDX с дефицитом дистрофина. Биохим. соц. Транс. 19 , 177С (1991).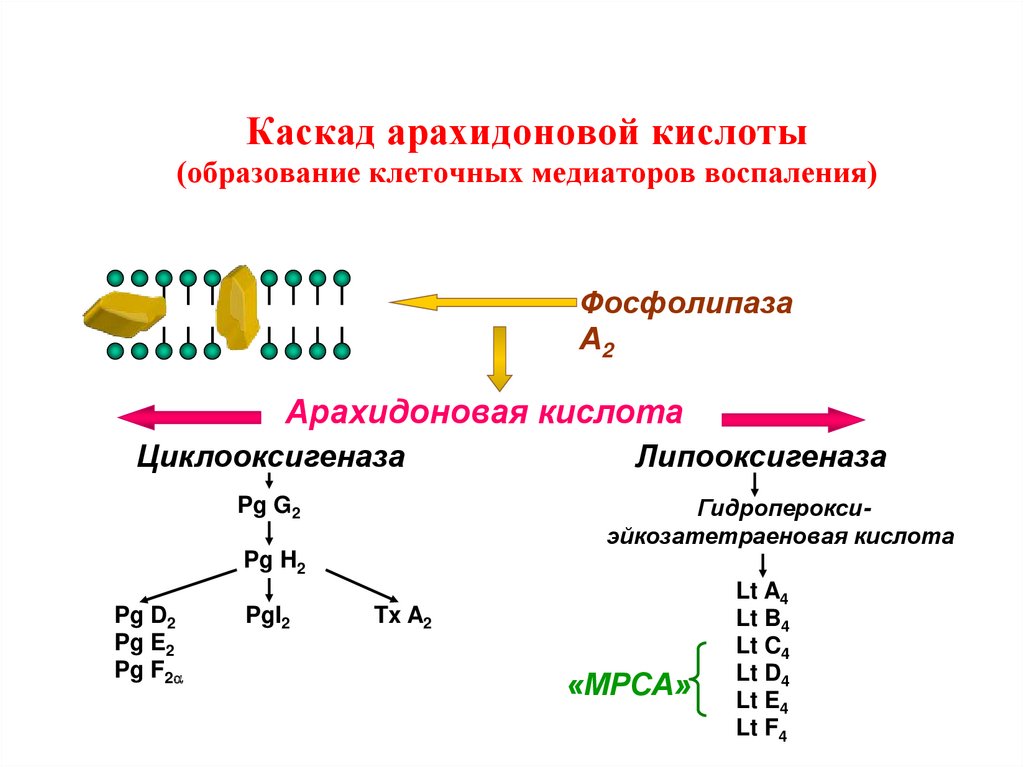 Акта Нейропатол. 104 , 377–384 (2002).
Акта Нейропатол. 104 , 377–384 (2002). Фосфолипиды, простагландин E2 и протеолиз в денервированных мышцах. утра. Дж. Физиол. 251 , R165–R173 (1986).
Фосфолипиды, простагландин E2 и протеолиз в денервированных мышцах. утра. Дж. Физиол. 251 , R165–R173 (1986).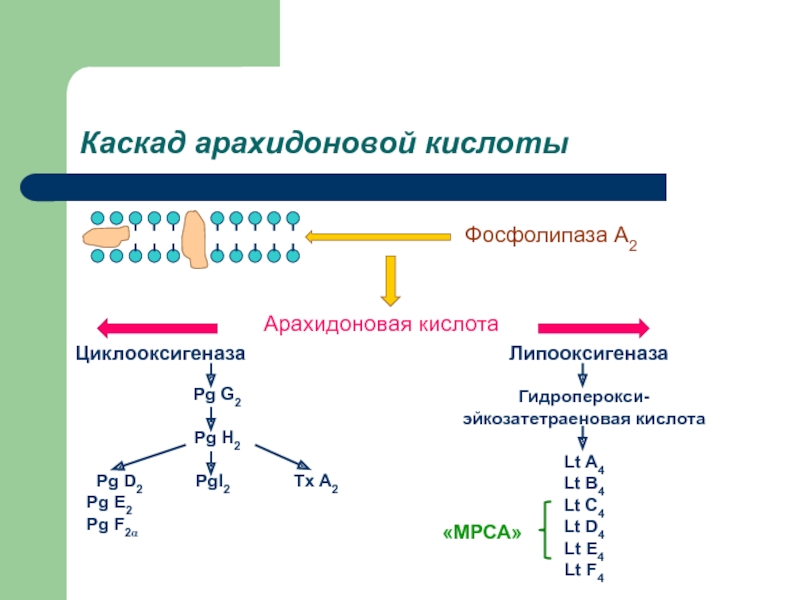 Акта Одонтол. Сканд. 59 , 348–355 (2001).
Акта Одонтол. Сканд. 59 , 348–355 (2001).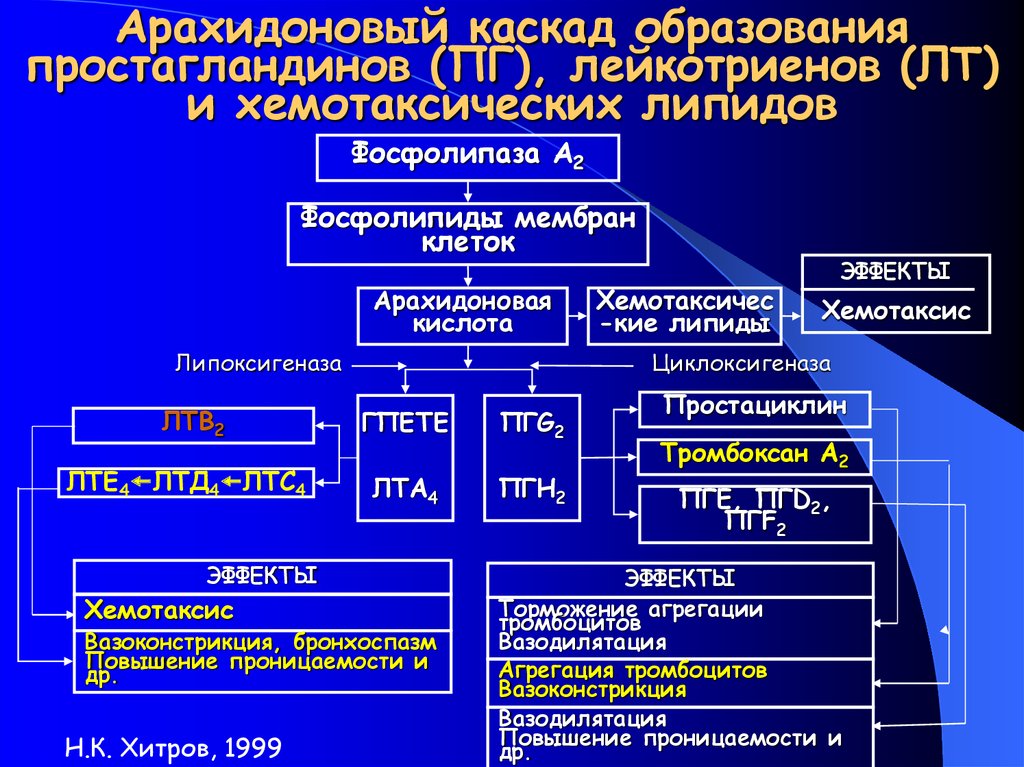 O., Zamir, O., James, J.H. & Fischer, J.E. Простагландин E2 не регулирует общий или миофибриллярный распад белка в инкубированных скелетных мышцах здоровых или септических крыс. Биохим. J. 270 , 45–50 (1990).
O., Zamir, O., James, J.H. & Fischer, J.E. Простагландин E2 не регулирует общий или миофибриллярный распад белка в инкубированных скелетных мышцах здоровых или септических крыс. Биохим. J. 270 , 45–50 (1990).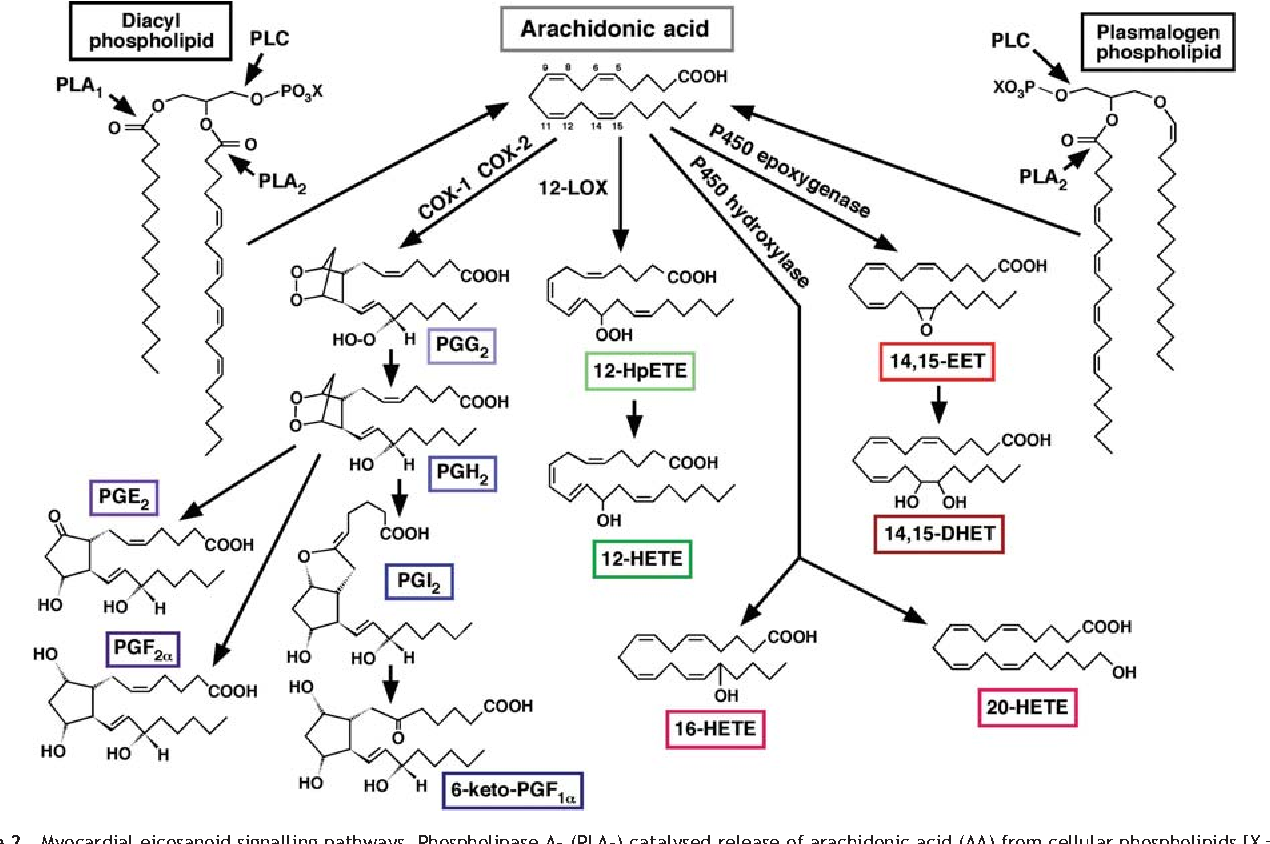 ).
). Дж. Физиол. Регул. интегр. Комп. Физиол. 304 , Р198–Р205 (2013).
Дж. Физиол. Регул. интегр. Комп. Физиол. 304 , Р198–Р205 (2013). , Соркин, Л.С. и Соммер, К. Внутримышечная инъекция фактора некроза опухоли-альфа вызывает мышечную гипералгезию у крыс. Боль 104 , 579–588 (2003).
, Соркин, Л.С. и Соммер, К. Внутримышечная инъекция фактора некроза опухоли-альфа вызывает мышечную гипералгезию у крыс. Боль 104 , 579–588 (2003). Снижение экспрессии интерлейкина-1альфа, интерлейкина-1бета и молекул клеточной адгезии в мышечной ткани после лечения кортикостероидами у пациентов с полимиозитом и дерматомиозитом. Ревматоидный артрит. 43 , 336–348 (2000).
Снижение экспрессии интерлейкина-1альфа, интерлейкина-1бета и молекул клеточной адгезии в мышечной ткани после лечения кортикостероидами у пациентов с полимиозитом и дерматомиозитом. Ревматоидный артрит. 43 , 336–348 (2000).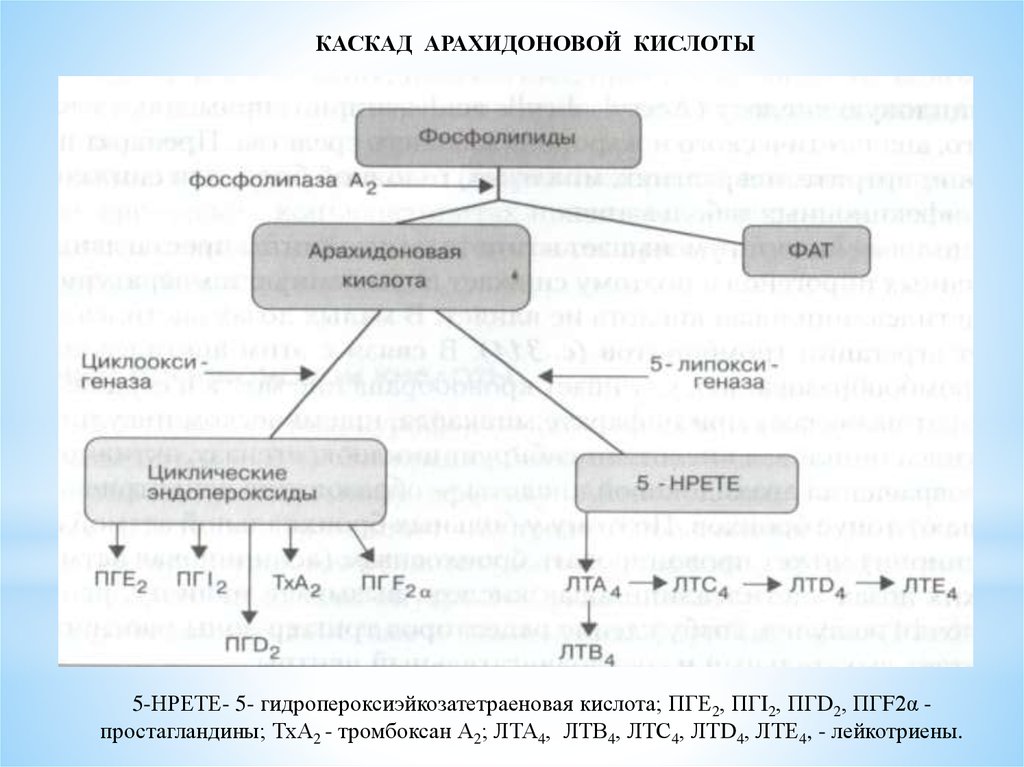 Д. Функция мышц при ХОБЛ: комплексное взаимодействие. Междунар. Дж. Хрон. Препятствовать. Пульмон. Дис. 7 , 523–535 (2012).
Д. Функция мышц при ХОБЛ: комплексное взаимодействие. Междунар. Дж. Хрон. Препятствовать. Пульмон. Дис. 7 , 523–535 (2012).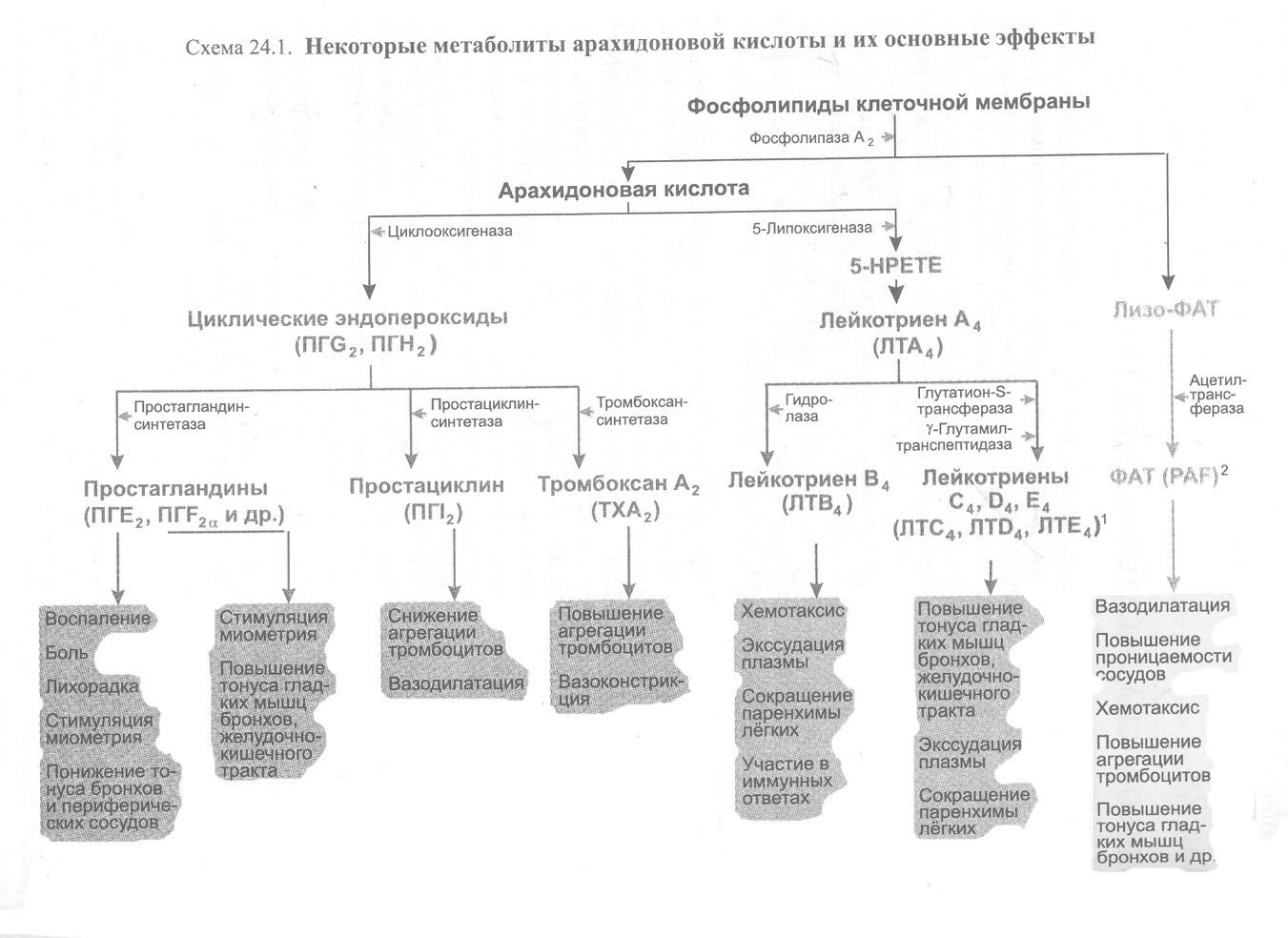 Влияние флавоноидов на стрессовые реакции в культурах миотрубочек. Дж. Агрик. Пищевая хим. 52 , 7158–7163 (2004).
Влияние флавоноидов на стрессовые реакции в культурах миотрубочек. Дж. Агрик. Пищевая хим. 52 , 7158–7163 (2004).