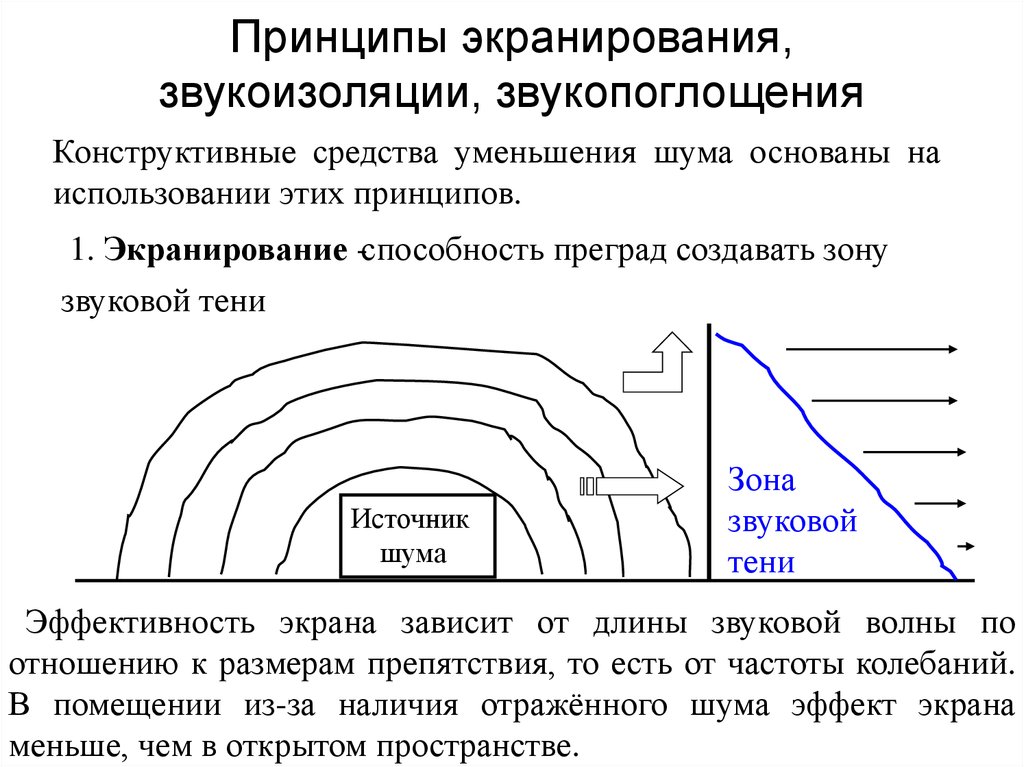
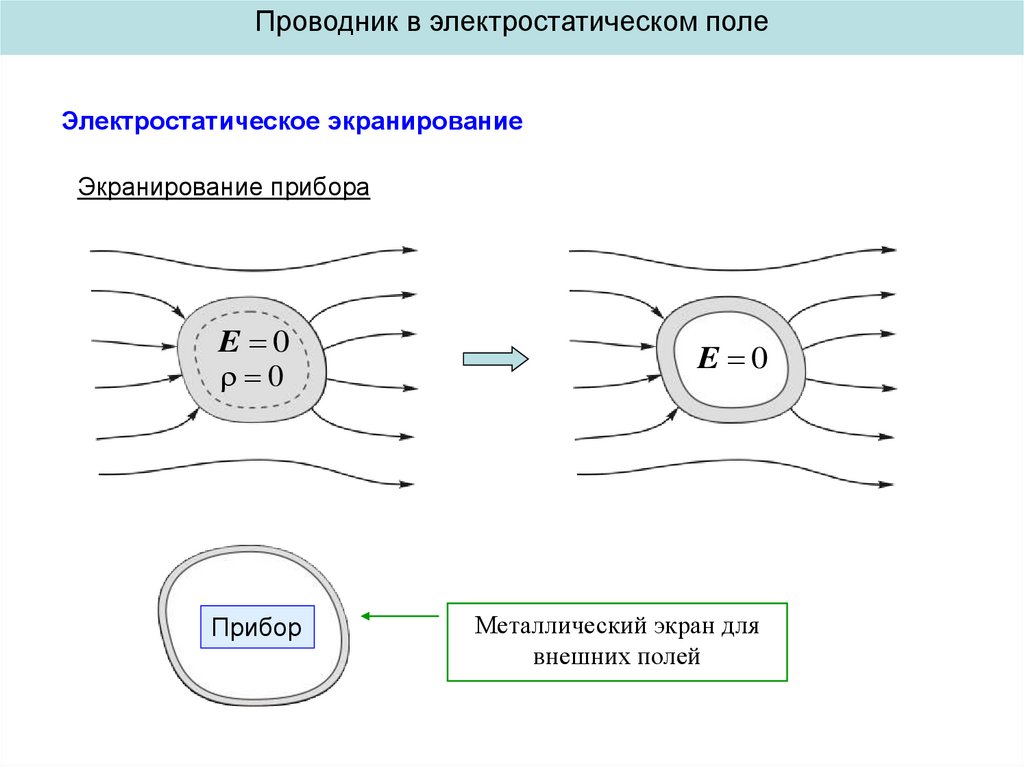
Эффект электронного экранирования в реакции D(3He,p)4He в дейтерированных металлах
Please use this identifier to cite or link to this item: http://earchive.tpu.ru/handle/11683/58554
| Title: | Эффект электронного экранирования в реакции D(3He,p)4He в дейтерированных металлах |
| Authors: | Нуркин, Азамат |
| metadata.dc.contributor.advisor: | Варлачев, Валерий Александрович |
| Keywords: | фактор усиления термоядерной реакции; потенциал экранирования; дейтериевая мишень; индекс Миллера; ускоритель Холла; enhancement factor; electron screening potential; deuterium target; Miller index; Hall accelerator |
| Issue Date: | 2020 |
| Citation: | Нуркин А. Эффект электронного экранирования в реакции D(3He,p)4He в дейтерированных металлах : дипломный проект / А. Нуркин ; Национальный исследовательский Томский политехнический университет (ТПУ), Управление магистратуры, аспирантуры и докторантуры (УМАД), Отдел аспирантуры и докторантуры (ОАиД) ; науч. |
| Abstract: | Эксперимент проводился на плазменном импульсном ускорителе холловского типа (г. Томск, ТПУ). В эксперименте энергия ионов 3He+ варьировалась в интервале E(3He) = 16 – 34 кэВ с шагом 2 кэВ. Целью данной работы являлось экспериментальное определение фактора усиления реакции D(3He, p)4He и потенциала электронного экранирования Ue с использованием TiD и ZrD мишеней. При этом использовались два типа мишеней с различной кристаллической структурой: каналирующей и экранирующей с индексами Миллера [100] и [111] соответственно. Мишени располагались на подложке из нержавеющей стали толщиной 50 мкм. Регистрация протонов из реакции D(3He, p)4He (Ep=14.7 МэВ) осуществлялась детектором на основе пластического сцинтиллятора. The D(3He, p)4He reaction was investigated at the pulsed plasma Hall accelerator (Tomsk) in the 3He+ energy range EHe = 16?34 keV (E = 6.41?13.61 keV in the center-of-mass system) with a step of 2 keV. The aim of this work was to experimentally determine the enhancement factor of the D(3He, p)4He reaction and the electron screening potential of Ue using TiD and ZrD targets.  In this work, two types of targets with different crystal structures were used: channeling and screening with Miller indices [100] and [111], respectively. Targets were placed on a stainless steel substrate 50 ?m thick. The registration of protons from the D(3He, p)4He reaction (Ep = 14.7 MeV) was carried out by the detector based on a plastic scintillator. In this work, two types of targets with different crystal structures were used: channeling and screening with Miller indices [100] and [111], respectively. Targets were placed on a stainless steel substrate 50 ?m thick. The registration of protons from the D(3He, p)4He reaction (Ep = 14.7 MeV) was carried out by the detector based on a plastic scintillator. |
| URI: | http://earchive.tpu.ru/handle/11683/58554 |
| Appears in Collections: | Научные доклады |
Show full item record Google Scholar
Обработка поверхностей | Fibox enclosures
Fibox Russia > Сервис > Специальные корпуса > Обработка поверхностей
FIBOX Make Difficult Easy
ОКРАШЕННЫЕ КОРПУСА
ЭЛЕКТРОМАГНИТНОЕ ЭКРАНИРОВАНИЕ — Пластиковые корпуса
ЭЛЕКТРОМАГНИТНОЕ ЭКРАНИРОВАНИЕ — Алюминиевые корпуса
ШЕЛКОТРАФАРЕТНАЯ ОКРАСКА КОРПУСОВ
ОКРАШЕННЫЕ КОРПУСА
|
|
При небольших объемах производства пластиковых корпусов нестандартный цвет получают окраской корпуса. Единственным способом получения нестандартного цвета для алюминиевых корпусов является их окраска. Предпочтительным способом является окраска полиэфирным порошком стандартных цветов RAL. Главным фактором достижения высокого качества и долгосрочной отделки является тщательная подготовка и очистка поверхности. Для алюминиевых корпусов возможны и другие способы обработки поверхности. За подробной информацией следует обращаться на завод. |
|
ЭЛЕКТРОМАГНИТНОЕ ЭКРАНИРОВАНИЕ Пластиковые корпуса Существует ряд способов экранирования, применимых к пластиковым корпусам. Помимо покрытия внутренних поверхностей проводящим материалом, для достижения высокой степени экранирования необходимо установить уплотнение из специального проводящего материала. Прекрасные результаты уплотнения по обкладке основания корпуса достигаются с помощью эластомера с серебряным наполнителем, такого как CHO-SEAL 1350. В сочетании с окраской никелем можно добиться достаточно эффективного уровня экранирования. |
. |
|
Таблица данных электромагнитного экранирования пластиковых корпусов
30 МГц 1030 МГц |
|
Алюминиевые корпуса Алюминиевые корпуса по своей природе являются проводящими, что делает их идеальными для защиты от радиопомех. Дополнительно требуется только проводящее уплотнение. Однако, чтобы использовать проводящее уплотнение, необходимо специальным образом подготовить корпус. Для этого требуется либо не красить паз под уплотнение, либо удалить краску с паза. Первый способ предпочтительнее, а соответствующий заказ можно сделать на заводе. Характеристики стандартного уплотнения CHO-SEAL 1350. Это уплотнение используется для пластиковых и алюминиевых корпусов FIBOX. Эффект экранирования в алюминиевых корпусах. |
|
Характеристика |
Процедура испытания |
|
| Связующий элемент из эластомера | Силикон | |
|
Проводящее наполнение |
Серебро/стекло | |
|
Объемное удельное |
0.01 | CEPS-0002 |
|
Жесткость |
65 +/- 5 |
А по Шору |
| Удлинение, мин. | 75 % | ASTM-D412 |
| Усадка при сжатии, 70 час. при 100 ° C, макс. |
30 % |
ASTM-D395 |
|
Низкотемпературная гибкость |
— 55 ° C | ASTM-D1329 |
|
Эффективность экранирования, дБ |
100 100 90 8 |
Модифиц. |
|
Удельное объемное |
0.01 | CEPS-0002 |
|
Объемное удельное |
0.01 | CEPS-0002 |
|
Эффект экранирования в алюминиевых корпусах |
|
|
дБ 80 60 |
30 МГц 1030 МГц |
Схема: |
Эффект экранирования от радиопомех для алюминиевого корпуса FIBOX Euronord II AL 121208; неокрашенная внутренняя поверхность и проводящее уплотнение Cho-Seal 1350.
|
Пластиковые и алюминиевые корпуса
Тампопечать (подушечная) является наилучшим решением для партий количеством более 1000 единиц. Ее можно использовать применительно как к плоским, так и к криволинейным поверхностям, а также к труднодоступным участкам, таким как внутренние поверхности. Общий размер более ограничен, чем при шелкотрафаретной печати. По обеим методикам можно выполнять печать от 1 до 3 цветов согласно спецификаций RAL или PMS. Хорошие результаты печати достигаются на черно-белой бумаге или пленке, подходящих для печати. Специальные требования к воспроизводимым оригинал-макетам можно получить на заводе. |
|
6.18: Электронное экранирование — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53709
 wikimedia.org/wiki/File:US_Army_52598_Army_Spouse_Skates_For_Roller_Derby_Team.jpg(откроется в новом окне); Лицензия: общественное достояние)
wikimedia.org/wiki/File:US_Army_52598_Army_Spouse_Skates_For_Roller_Derby_Team.jpg(откроется в новом окне); Лицензия: общественное достояние)Какова цель игры в роллер-дерби?
Роллер-дерби — популярный вид спорта, хотя многим он не знаком. Основная цель состоит в том, чтобы заставить одного члена команды («глушителя») пройти мимо команды соперника, чтобы набрать очки. Другие члены команды служат блокираторами, чтобы помешать команде противника остановить глушитель. Блокирующие мешают взаимодействию между глушителем и соперниками, вставая между глушителем и фигуристами, пытающимися их остановить.
Притяжение между электроном и ядром атома — непростая проблема. Только с водородом существует взаимосвязь один к одному, которую можно обсуждать с точки зрения прямого притяжения заряда. По мере увеличения размера атома количество протонов и электронов также увеличивается. Эти изменения влияют на то, как ядро притягивает электроны.
Электронное экранирование
В целом, энергия ионизации атома будет увеличиваться по мере того, как мы движемся слева направо по таблице Менделеева.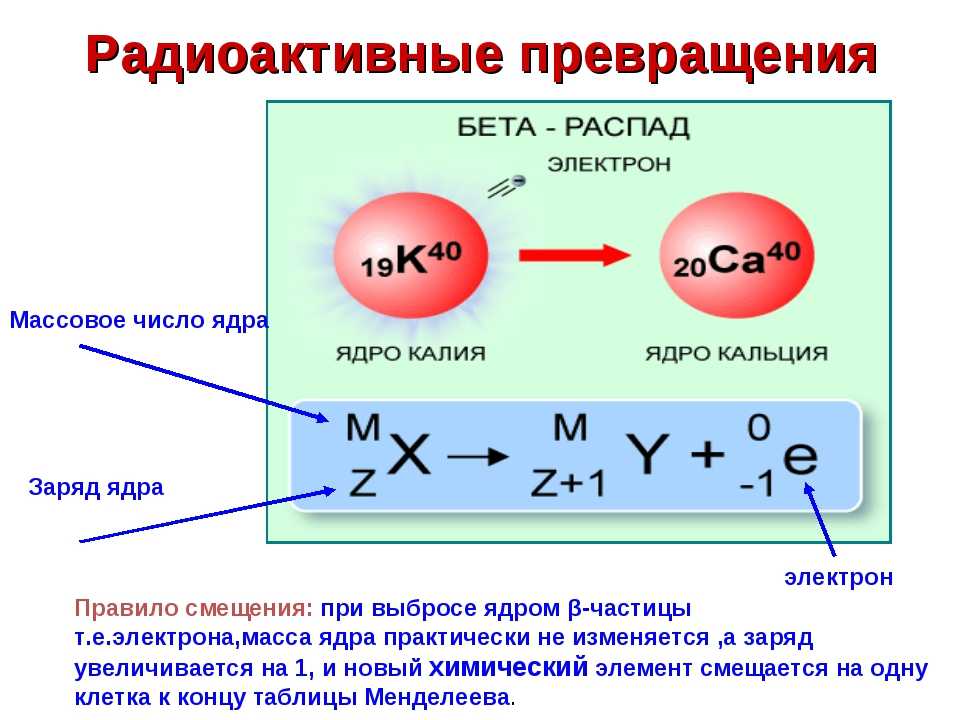 Есть несколько исключений из общего увеличения энергии ионизации в течение периода. Элементы группы 13 (\(\ce{B}\), \(\ce{Al}\) и др.) имеют более низкую энергию ионизации, чем элементы группы 2 (\(\ce{Be}\), \(\ce{Mg}\) и т. д.). Это иллюстрация концепции под названием « электронное экранирование «. Внешние электроны частично экранированы внутренними электронами от силы притяжения протонов в ядре.
Есть несколько исключений из общего увеличения энергии ионизации в течение периода. Элементы группы 13 (\(\ce{B}\), \(\ce{Al}\) и др.) имеют более низкую энергию ионизации, чем элементы группы 2 (\(\ce{Be}\), \(\ce{Mg}\) и т. д.). Это иллюстрация концепции под названием « электронное экранирование «. Внешние электроны частично экранированы внутренними электронами от силы притяжения протонов в ядре.
Чтобы объяснить, как работает экранирование, рассмотрим атом лития. Он имеет три протона и три электрона — два на первом основном энергетическом уровне и его валентный электрон на втором. Валентный электрон частично экранирован от силы притяжения ядра двумя внутренними электронами. Удаление этого валентного электрона становится легче из-за экранирующего эффекта.
Существует также экранирующий эффект, возникающий между подуровнями в пределах одного основного энергетического уровня. В частности, электрон на подуровне \(s\) способен экранировать электроны на подуровне \(p\) того же главного энергетического уровня. Это происходит из-за сферической формы орбитали \(s\). Обратное неверно — электроны на \(р\)-орбиталях не экранируют электроны на \(s\)-орбиталях.
Рисунок \(\PageIndex{3}\): Сферическая \(3s\)-орбиталь оказывает экранирующее воздействие на гантелевидную \(3p\)-орбиталь с несколько более высокой энергией. Это уменьшает энергию ионизации \(3p\) электрона по сравнению с \(3s\) электроном. (Источник: Christopher Auyeung; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (opens in new window)) Электрон, удаленный из атома \(\ce{Al}\), представляет собой \(3p\ ) электрон, экранированный двумя \(3s\) электронами, а также всеми электронами внутреннего ядра . Электрон, удаляемый из атома \(\ce{Mg}\), представляет собой \(3s\) электрон, который экранируется только электронами внутреннего остова. Поскольку в атоме \(\ce{Al}\) имеется большая степень электронного экранирования, удалить валентный электрон немного легче; его энергия ионизации меньше, чем у \(\ce{Mg}\). И это несмотря на то, что ядро атома \(\ce{Al}\) содержит на один протон больше, чем ядро атома \(\ce{Mg}\).
Поскольку в атоме \(\ce{Al}\) имеется большая степень электронного экранирования, удалить валентный электрон немного легче; его энергия ионизации меньше, чем у \(\ce{Mg}\). И это несмотря на то, что ядро атома \(\ce{Al}\) содержит на один протон больше, чем ядро атома \(\ce{Mg}\).
Существует еще одна аномалия между группами 15 и 16. Атомы группы 16 (\(\ce{O}\), \(\ce{S}\) и т. д.) имеют более низкие энергии ионизации, чем атомы группы 15 ( \(\ce{N}\), \(\ce{P}\) и т. д.). За объяснением стоит правило Хунда. В атоме азота на подуровне \(2р\) находится три электрона, и каждый из них неспарен. В атоме кислорода на подуровне \(2р\) находится четыре электрона, поэтому на одной орбитали находится пара электронов. Именно этот второй электрон на орбитали удаляется при ионизации атома кислорода. Поскольку электроны отталкиваются друг от друга, удалить электрон из спаренного набора в атоме кислорода несколько легче, чем удалить неспаренный электрон из атома азота.
youtube.com/embed/KaJiiHKOFAc?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>Резюме
- Электронное экранирование означает блокирование притяжения электронов валентной оболочки ядром из-за присутствия электронов внутренней оболочки.
- Электроны на \(s\)-орбитали могут экранировать \(p\) электроны на том же энергетическом уровне из-за сферической формы \(s\)-орбитали.
- Электроны в конфигурациях со сдвоенными спинами удалить немного легче, чем неспаренные электроны.
Обзор
- Дайте определение «электронному экранированию».
- Почему элементы группы 13 имеют более низкую энергию ионизации, чем элементы группы 2?
- Какое влияние оказывает больший экранирующий эффект на энергию ионизации?
- Как s-орбитальные электроны влияют на энергию ионизации p-электрона в той же оболочке?
- Почему атомы группы 16 имеют более низкую энергию ионизации, чем соответствующие атомы группы 15?
Эта страница под названием 6. 18: Электронное экранирование распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
18: Электронное экранирование распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- экран
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Защитный эффект: Определение, Атомный, Формула
Представьте, что у вас есть 2 сильных магнита, из-за их притяжения их трудно разъединить. Если вы добавите между ними бумагу, их будет легче разъединить. Теперь представьте, что вы добавили между ними 20 страниц бумаги. Что ж, теперь их намного проще разобрать. Это потому, что бумага экранирует магниты друг от друга. Что касается экранирующего эффекта в химии, электроны экранируются от положительного заряда ядра.
Каждый уровень электронов действует как еще один лист бумаги, который блокирует некоторый заряд от достижения электрона, на который мы смотрим. В этой статье мы рассмотрим, как экранирующий эффект работает и как он влияет на вовлеченные электроны.
- Эта статья о экранирующем эффекте
- Мы узнаем, как рассчитать эффективный заряд ядра и понять его периодические тенденции
- Затем мы рассмотрим, как экранирующий эффект влияет на атомный радиус
- Наконец, мы рассмотрим проникновение электронов , чтобы понять, почему одни электроны лучше экранируют, чем другие
Определение эффекта экранирования
Начнем с определения эффекта экранирования.
Экранирующий эффект описывает, как электроны, находящиеся ближе к ядру, «экранируют» электроны, находящиеся дальше от положительного заряда ядра.
Итак, что именно мы подразумеваем под «экранированием»? Вот базовая схема атома:
Электроны ядра (светло-голубые) защищают валентные электроны (темно-синие) от части заряда ядра. StudySmarter Оригинал
Разные кольца представляют разные энергетические уровни. Электроны светло-голубого цвета — это основных электрона , это все электроны, не находящиеся во внешней оболочке. Электроны, выделенные темно-синим цветом, — это валентных электрона, — это электроны на внешней оболочке, это также электроны, участвующие в связывании.
Электроны, выделенные темно-синим цветом, — это валентных электрона, — это электроны на внешней оболочке, это также электроны, участвующие в связывании.
Электроны будут отталкивать другие электроны, поэтому, когда эти электроны вращаются вокруг ядра, они почувствуют небольшой «толчок». Однако они все еще «притягиваются» ядром. «Толкание» электронов ядра сводит на нет некоторое «притягивание» ядра, подобное перетягиванию каната.
Формула экранирующего эффекта
Мы представляем экранирование с помощью формулы экранирующего эффекта для Z eff .
Z eff (Эффективный заряд ядра) — это заряд, который электрон «чувствует», когда он экранирован. Уравнение для этого:
$$Z_{eff}=Z-S$$
Где Z — количество протонов, а S — количество основных электронов (или электронов между электроном и ядром).
Так, З eff , — это чистое «притяжение», которое ощущает наш электрон. Обычно нас интересует только Z eff , валентных электронов, но электроны на более низких энергетических уровнях по-прежнему испытывают экранирующий эффект. Давайте рассмотрим пример:
Обычно нас интересует только Z eff , валентных электронов, но электроны на более низких энергетических уровнях по-прежнему испытывают экранирующий эффект. Давайте рассмотрим пример:
Рассчитайте Z eff для валентного электрона фтора.
Атомный номер фтора равен 9, поэтому у него 9 протонов. Когда мы заполняем наши электронные оболочки, первая содержит 2 электрона, а каждая последующая содержит 8. Таким образом, у фтора есть только 2 основных электрона и 7 валентных электронов. $$\begin {align}Z_{eff}&=Z-S \\Z_{эфф}&=9-2 \\Z_{eff}&=7\end {align} $$
Итак, теперь мы знаем, что Z eff для валентного электрона во фторе равно 7, так что же в точности означает ? Чтобы лучше это понять, давайте рассмотрим другой пример:
Рассчитайте Z эфф валентного электрона в бериллии.
Атомный номер бериллия равен 4, поэтому у него 4 протона. Он также имеет 2 основных электрона. $$\begin {align}Z_{eff}&=Z-S \\Z_{eff}&=4-2 \\Z_{eff}&=2\end {align}$$
Итак, Z eff бериллия равно 2, а фтора 7. Это связано с их зарядом и тем, как они связаны. Заряд наиболее распространенного иона бериллия, катиона бериллия, равен +2, что означает, что он может потерять 2 электрона. Однако заряд наиболее распространенного иона фтора, аниона фторида, имеет заряд -1, поэтому он хочет получить 1 электрон, чтобы заполнить свой октет (самая внешняя оболочка может содержать 8 электронов).
Это связано с их зарядом и тем, как они связаны. Заряд наиболее распространенного иона бериллия, катиона бериллия, равен +2, что означает, что он может потерять 2 электрона. Однако заряд наиболее распространенного иона фтора, аниона фторида, имеет заряд -1, поэтому он хочет получить 1 электрон, чтобы заполнить свой октет (самая внешняя оболочка может содержать 8 электронов).
Ядро фтора имеет большее притяжение к своим валентным электронам, поэтому эти электроны хотят остаться там, где они есть, и получить электрон, в то время как бериллий имеет более слабое притяжение, поэтому они с большей вероятностью уйдут.
Величина Z eff связана с тем, насколько «сильно» ядро притягивает эти электроны. Чем сильнее притяжение, тем больше вероятность того, что эти электроны останутся на месте.
Основываясь на наших предыдущих примерах, мы видим, что при просмотре периодической таблицы Z eff больше. Это связано с тем, что эти элементы имеют одинаковое количество остовных электронов (то есть одинаковый экранирующий эффект), но Z eff становится больше.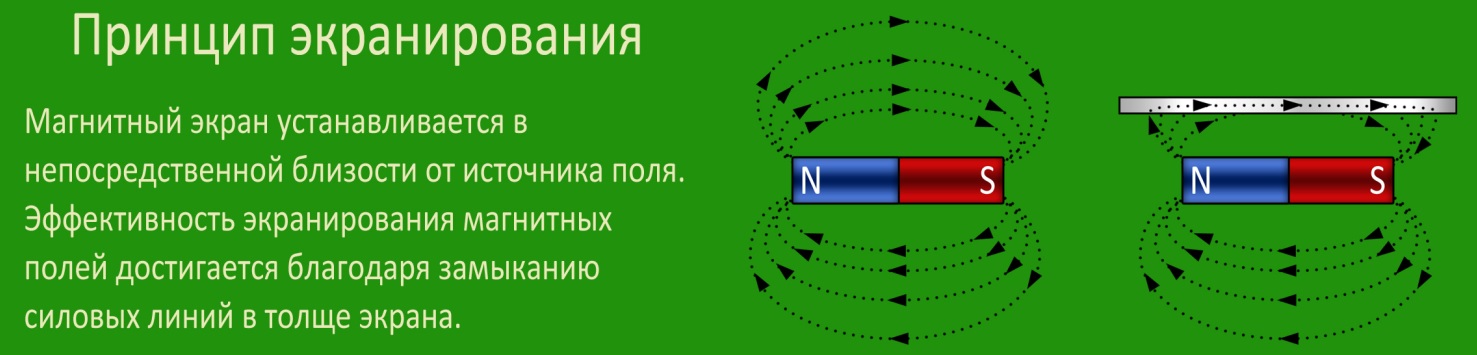 По мере того, как вы проходите через периодическую таблицу, добавляются только валентные электроны, которые не очень эффективны для экранирования, поскольку находятся на одном энергетическом уровне.
По мере того, как вы проходите через периодическую таблицу, добавляются только валентные электроны, которые не очень эффективны для экранирования, поскольку находятся на одном энергетическом уровне.
Экранирующий эффект на атомный радиус
Экранирующий эффект играет важную роль в определении атомного радиуса. Чем сильнее «хватка» ядра за свои электроны, тем меньше радиус атома. По мере перемещения по столу радиус уменьшается. Как мы видели с бериллием и фтором, Z eff увеличивается, следовательно, увеличивается «хватка». Поскольку сила притяжения ядра больше, электроны удерживаются ближе друг к другу, а это означает, что атомный радиус становится меньше.
Когда мы двигаемся вниз (сверху вниз) по таблице Менделеева, атомный радиус увеличивается. По мере добавления дополнительных энергетических уровней расстояние между самыми внешними электронами и ядром становится все больше и больше. Экранирующий эффект увеличивается из-за дополнительных электронов.
Факторы, влияющие на экранирующий эффект
Уравнение, которое мы использовали для Z eff , полезно для демонстрации различий между элементами за один и тот же период, но на самом деле оно не раскрывает всей истории. Настоящий Z эфф также зависит от проникновения электронов .
Электронное проникновение описывает, насколько близко электроны на орбите находятся к ядру. По мере того, как вы приближаетесь, электроны могут «блокировать» заряд от электронов, находящихся дальше.
Вот поясняющая диаграмма:
В зависимости от того, на какой орбитали находится электрон, вероятность того, что электрон будет находиться на определенном расстоянии от ядра, основана на приведенных выше кривых (данные для водорода). Исследуй умнее Оригинал.
«Радиальная вероятность» — это просто модное слово, обозначающее «насколько вероятно, что здесь находится электрон». Так, например, если электрон находится на 1s-орбитали, очень вероятно, что он будет близко к ядру. Поскольку 2s-электрон, вероятно, находится дальше, он будет экранирован 1s-электронами. Для электронов на одном и том же энергетическом уровне проникающая способность выглядит следующим образом: \(s\gt p\gt d\приблизительно f\)
Так, например, если электрон находится на 1s-орбитали, очень вероятно, что он будет близко к ядру. Поскольку 2s-электрон, вероятно, находится дальше, он будет экранирован 1s-электронами. Для электронов на одном и том же энергетическом уровне проникающая способность выглядит следующим образом: \(s\gt p\gt d\приблизительно f\)
0025 $$ 1s\gt 2s\gt 2p\gt 3s\gt 3p\gt 4s\gt 3d\gt 4p \gt 5s\gt 4d\gt 5p\gt 6s\gt 4f …. $$
Теперь давайте сравните фактический Z eff для фтора с тем, что мы рассчитали ранее. Для 1s-электронов Z эф = 8,65, для 2s Z эф = 5,13 и для 2p Z эф = 5,10. Таким образом, это сильно отличается от Z eff , которое мы рассчитали ранее, которое равнялось 7 для фтора. В наших предыдущих расчетах все электроны считались «равными», что на самом деле не так. Мы вычисляем эти другие Z eff на основе Правил Слейтера.
Правила Слейтера Правила Слейтера используются для расчета Z eff с учетом проникновения электронов. Эти правила следующие: Для s- и p-орбитальных электронов:
Эти правила следующие: Для s- и p-орбитальных электронов:
электронов в пределах одного группового экрана 0,35 (кроме 1s, который равен 0,30)
электронов в пределах n-1 группового экрана 0,85
электроны в группе n-2 или ниже экрана 1,00
Для d- и f-орбитальных электронов:
- электронов в пределах одной группы экранируют 0,35
- электронов на всех других нижних уровнях экранируют 1,00
), а затем мы подставим его в наше уравнение до
.
Прежде чем мы приступим к практической задаче, давайте кратко вспомним конфигурацию электрона.
В зависимости от того, где находится элемент в периодической таблице, его электроны будут заполнять отмеченные орбитали, двигаясь слева направо. Исследуй умнее Оригинал.
Вы заполняете свои орбитали справа налево, пока не дойдете до элемента, на который смотрите. Энергетический уровень эквивалентен периоду для s- и p-орбиталей. Для d-орбиталей это n-1, а для f-орбиталей это n-2. Каждая суборбиталь может содержать 2 электрона, s-орбитали имеют 1 суборбиталь, p-орбитали имеют 3, d-орбитали имеют 5, а f-орбитали имеют 7. Так, например, F имеет электронную конфигурацию 1s 2 2s 2 2п 5 .
Для d-орбиталей это n-1, а для f-орбиталей это n-2. Каждая суборбиталь может содержать 2 электрона, s-орбитали имеют 1 суборбиталь, p-орбитали имеют 3, d-орбитали имеют 5, а f-орбитали имеют 7. Так, например, F имеет электронную конфигурацию 1s 2 2s 2 2п 5 .
Рассчитать константу экранирования, S и Z eff для 3p-электрона в хлоре.
Хлор имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 5 . Используя правила Слейтера, мы можем вычислить S
$$0,35(7)+0,85(8)+1,00(2)=11,25$$
Теперь для Z eff . Атомный номер хлора 17, поэтому у него 17 протонов.
$$Z_{eff}=Z-S$$
$$Z_{eff}=17-11,25$$$$Z_{eff}=5,75$$
Для сравнения, если мы обработаем каждый остовный электрон одинаковым «вес», Z eff будет 7. Таким образом, экранирующий эффект на самом деле s сильнее , если принять во внимание эти правила.
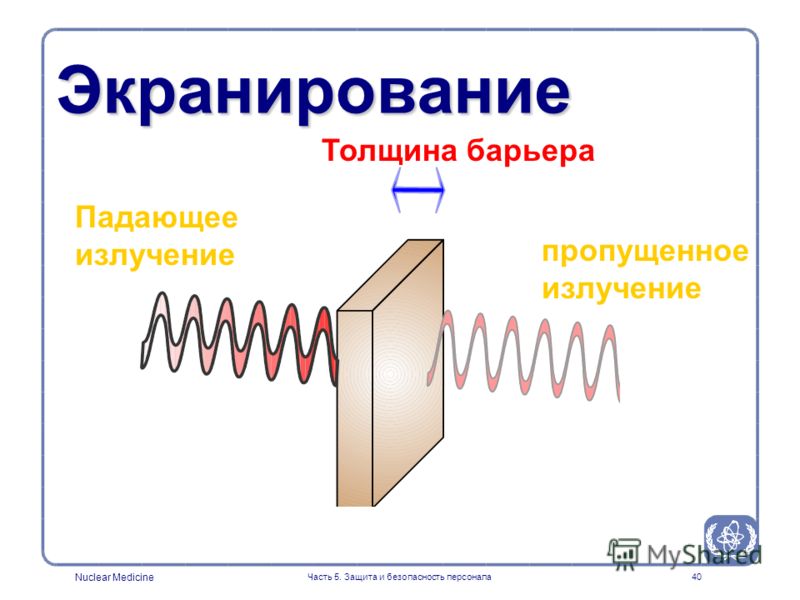
 Характеристики этих способов указаны в приведенной ниже таблице. Из таблицы видно, что наиболее рентабельным вариантом является окраска никелем, а самым дорогостоящим – окраска серебром.
Характеристики этих способов указаны в приведенной ниже таблице. Из таблицы видно, что наиболее рентабельным вариантом является окраска никелем, а самым дорогостоящим – окраска серебром.
 1
1 1
1
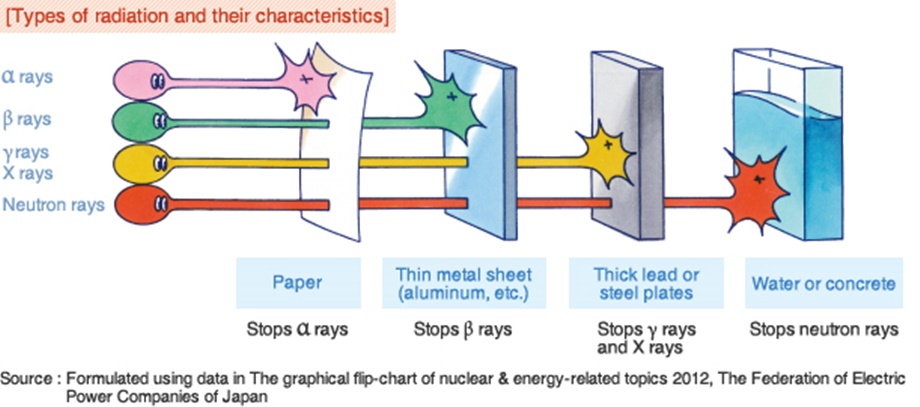
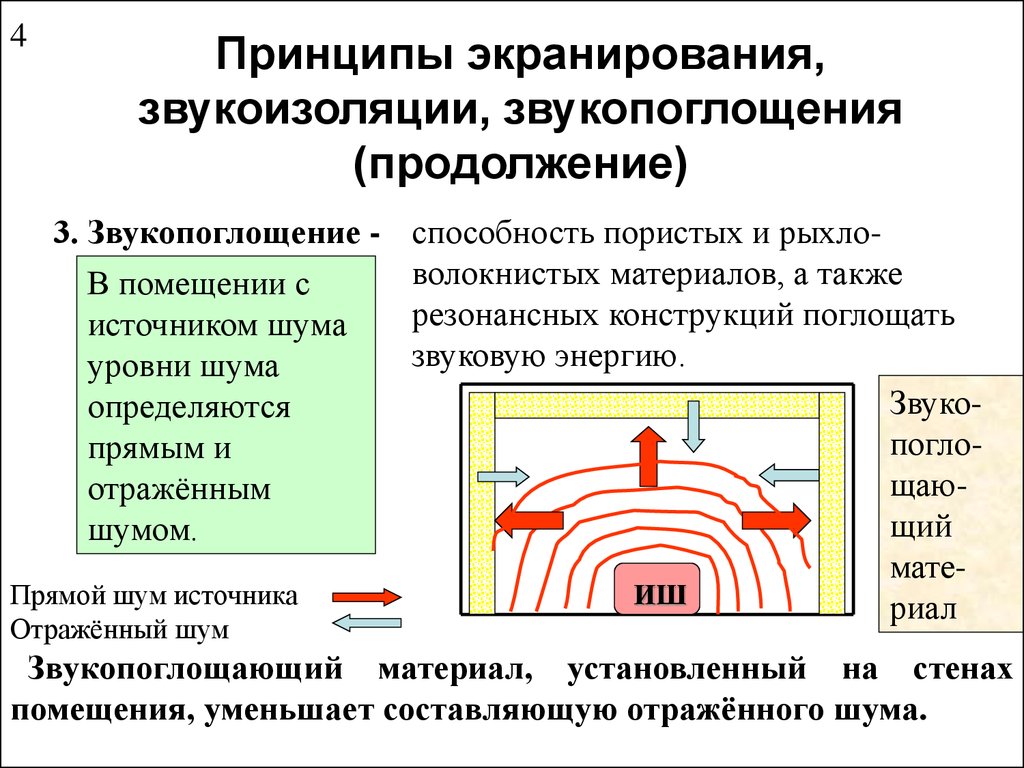 , так
, так