Cutrin Гель для структурирования волос Volume perfection
Смотреть 106 товаров: Гель для волосУход Для волос Средство для объема волос Гель для волос
Cutrin
Гель для структурирования волос Volume perfection
+
+
=
1269 ₽
Характеристики товараОписание
Характеристики
Эффект:
Для объема / Для блеска / Мягкость волос / Текстурирующий / Стайлинг / Для гладкости
Тип волос:
Для жестких
Особенность использования:
Создание локонов
Пол и возраст:
Женский
Свойства лака для волос:
Профессиональный
5 раз добавили в список желаний
Способ применения
Область применения:
1. Прикорневой объем:
Гель для структурирования волос VolumePerfection дает волосам поддержку и прикорневой объем без создания завитков.
2. Смягчение жестких волос:
Мужские жесткие короткие волосы могут быть смягчены без применения бигуди путем нанесения геля на участок с жесткими волосами.
3. Завивка отросших волос:
Если волосы по длине и на концах все еще вьются, эффект завивки можно продлить, сделав волны только у корня. Накрутите волосы на бигуди в обычном порядке и нанесите гель только на корни.
4. Повторная завивка волос и использование вместе с Perfection perming lotion:
Cutrin VolumePerfection также можно применять, если корни отрасли больше, чем на 5 см. Волосы предварительно следует обработать с помощью кондиционера Perfection Pre-perm conditioner, а затем накрутить на бигуди в обычном порядке. Волосы на концах и посредине должны быть увлажнены с помощью лосьона Cutrin Perfection C perming lotion (или иного Perfection perming lotion, подходящего для данного типа волос).
Прикорневой объем:
Гель для структурирования волос VolumePerfection дает волосам поддержку и прикорневой объем без создания завитков.
2. Смягчение жестких волос:
Мужские жесткие короткие волосы могут быть смягчены без применения бигуди путем нанесения геля на участок с жесткими волосами.
3. Завивка отросших волос:
Если волосы по длине и на концах все еще вьются, эффект завивки можно продлить, сделав волны только у корня. Накрутите волосы на бигуди в обычном порядке и нанесите гель только на корни.
4. Повторная завивка волос и использование вместе с Perfection perming lotion:
Cutrin VolumePerfection также можно применять, если корни отрасли больше, чем на 5 см. Волосы предварительно следует обработать с помощью кондиционера Perfection Pre-perm conditioner, а затем накрутить на бигуди в обычном порядке. Волосы на концах и посредине должны быть увлажнены с помощью лосьона Cutrin Perfection C perming lotion (или иного Perfection perming lotion, подходящего для данного типа волос).
Вверх
Средства для структурирования волос в Энгельсе: 594-товара: бесплатная доставка, скидка-10% [перейти]
Партнерская программаПомощь
Энгельс
Каталог
Каталог Товаров
Одежда и обувьОдежда и обувь
СтройматериалыСтройматериалы
Текстиль и кожаТекстиль и кожа
Здоровье и красотаЗдоровье и красота
Детские товарыДетские товары
Продукты и напиткиПродукты и напитки
ЭлектротехникаЭлектротехника
Дом и садДом и сад
Торговля и складТорговля и склад
ПромышленностьПромышленность
Мебель и интерьерМебель и интерьер
Все категории
ВходИзбранное
Likato Professional / Спрей KERALESS для сглаживания структуры волос с термозащитным эффектом 100 мл
ПОДРОБНЕЕБелита, Интенсивная терапия, Мгновенный восстановитель структуры волос, несмываемый, 250мл Бренд:
ПОДРОБНЕЕLikato Professional / Спрей KERALESS для сглаживания структуры волос с термозащитным эффектом 100 мл
ПОДРОБНЕЕDr. Sante Keratin Спрей для тусклых и ломких волос Восстановление Структуры Волос с кератином, аргинином, коллагеном, 150 мл
Sante Keratin Спрей для тусклых и ломких волос Восстановление Структуры Волос с кератином, аргинином, коллагеном, 150 мл
Starpil эмульсия после депиляции с приостановлением роста волос (500 мл) Тип: Эмульсия с
В МАГАЗИН-10%
512
569
Крем-бальзам Мивал для роста и регенерации волос 100 мл Объем, мл: 100, Срок годности, мес.: 12,
В МАГАЗИНКрем замедляющий рост волос Пачули-Лаванда-Ваниль Aroma Dead Sea (Арома Дэд Си) 150 мл Действие:
В МАГАЗИНHAIR-G THERAPY Serum Терапевтическая сыворотка против выпадения волос Hikari (Хикари) 30 мл
В МАГАЗИНBeaver Интенсивная лечебная маска для волос (Intensive Remedy Treatment Mask 500 ml) Объем: 0.5000
В МАГАЗИНБлеск-тонер JOICO полуперманентный/натуральный золотистый, 60 мл Бренд: JOICO, Объем: 60
В МАГАЗИНEucapil (Эвкапил) — средство против выпадения волос, 30*2мл
В МАГАЗИН-10%
1 831
2034
FARMAVITA, Кристальные капли Hd Crystal Drops, 100 мл. Тип продукта: Флюиды, Объём: 100, Тип волос:
Тип продукта: Флюиды, Объём: 100, Тип волос:
CONSTANT DELIGHT, Восстанавливающий мусс для волос с отрубями, 250 мл. Тип продукта: Муссы, Объём:
ПОДРОБНЕЕCONSTANT DELIGHT, Ламинирующий гель Spa, 500 мл. Тип продукта: Гели, Объём: 500, Тип волос: Для
ПОДРОБНЕЕCONSTANT DELIGHT, Горячее обертывание для поврежденных и слабых волос с протеинами шелка Spa,500 мл.
ПОДРОБНЕЕCONSTANT DELIGHT, Реконструктор интенсивный Botox, 500 мл. Тип продукта: Бальзамы, Объём: 500, Тип
ПОДРОБНЕЕ-10%
1 728
1920
ALCINA, Пена для окрашенных волос, 150 мл. Тип продукта: Пенки, Объём: 150, Тип волос: Окрашенные
ПОДРОБНЕЕ-10%
4 860
5400
ALCINA, Маска восстанавливающая (Ухаживающий фактор 1), 1250 мл. Тип продукта: Маски, Объём: 1250,
ПОДРОБНЕЕСредство для глазирования волос JPS mielle natural fix glaze Объем: 500
ПОДРОБНЕЕСпрей для укладки и объема волос JPS mielle black iron spray Объем: 300
ПОДРОБНЕЕСредство для глазирования волос JPS zab hair revolume glaze Вариант: 500 мл, Объем: 500
ПОДРОБНЕЕСпрей восстанавливающий для волос Welcos zen-care ss treatment Объем: 500
ПОДРОБНЕЕPetal Fresh Pure Clarifying Conditioner Rose & Honeysuckle 16 fl oz (475 ml) Вес: 0. 50000000
50000000
-35%
2 253
3466
CHI Color Illuminate Silver Blonde Оттеночный кондиционер серебристый блондин, 251 мл. Линейка:
ПОДРОБНЕЕBabo Botanicals Средство для запутанных волос мгновенной гладкости ягоды и примула 8 жидких унций (237 мл)
ПОДРОБНЕЕТонирующая крем-краска Goldwell Colorance cover plus 7ll natural
ПОДРОБНЕЕNeocell Средство для придания объема волосам с кератином 60 капсул Вес: 0.11000000
ПОДРОБНЕЕ2 страница из 18
Средства для структурирования волос
Текстура волос определяется генетикой?: MedlinePlus Genetics
Генетические факторы играют важную роль в определении текстуры волос — прямых, волнистых или вьющихся — и толщины отдельных прядей волос. Исследования показывают, что разные гены влияют на текстуру и толщину волос у людей разного этнического происхождения. Например, нормальные вариации (полиморфизмы) в двух генах, EDAR и FGFR2 , были связаны с различиями в толщине волос в азиатских популяциях. Полиморфизм в другом гене, TCHH , по-видимому, связано с различиями в структуре волос у людей североевропейского происхождения. Вполне вероятно, что многие дополнительные гены вносят вклад в текстуру и толщину волос в различных популяциях.
Полиморфизм в другом гене, TCHH , по-видимому, связано с различиями в структуре волос у людей североевропейского происхождения. Вполне вероятно, что многие дополнительные гены вносят вклад в текстуру и толщину волос в различных популяциях.
Несколько генетических синдромов характеризуются необычной текстурой волос. Эти синдромы вызываются вариантами генов, играющих роль в структуре и стабильности волос, в том числе генами, связанными со специализированными клеточными структурами, называемыми десмосомами, которые удерживают клетки волос вместе, белками, называемыми кератинами, которые обеспечивают прочность и устойчивость прядей волос, и химическими сигнальными путями, включающими молекула под названием лизофосфатидная кислота (LPA), которая способствует росту волос. Генетические синдромы с измененной текстурой волос включают:
Аутосомно-рецессивный гипотрихоз (вызванный вариантами в гене DSG4 , LIPH или LPAR6
Кератодермия с пушистыми волосами (вызвана вариантами в гене JUP , DSP , DSC2 или KANK2 )
Monilethrix (вызван вариантами в гене DSG4 , KRT81 , KRT83 или KRT86 )
Синдром непослушных волос (вызван вариантами генов PADI3 , TCHH или TGM3 )
текстура и густота волос.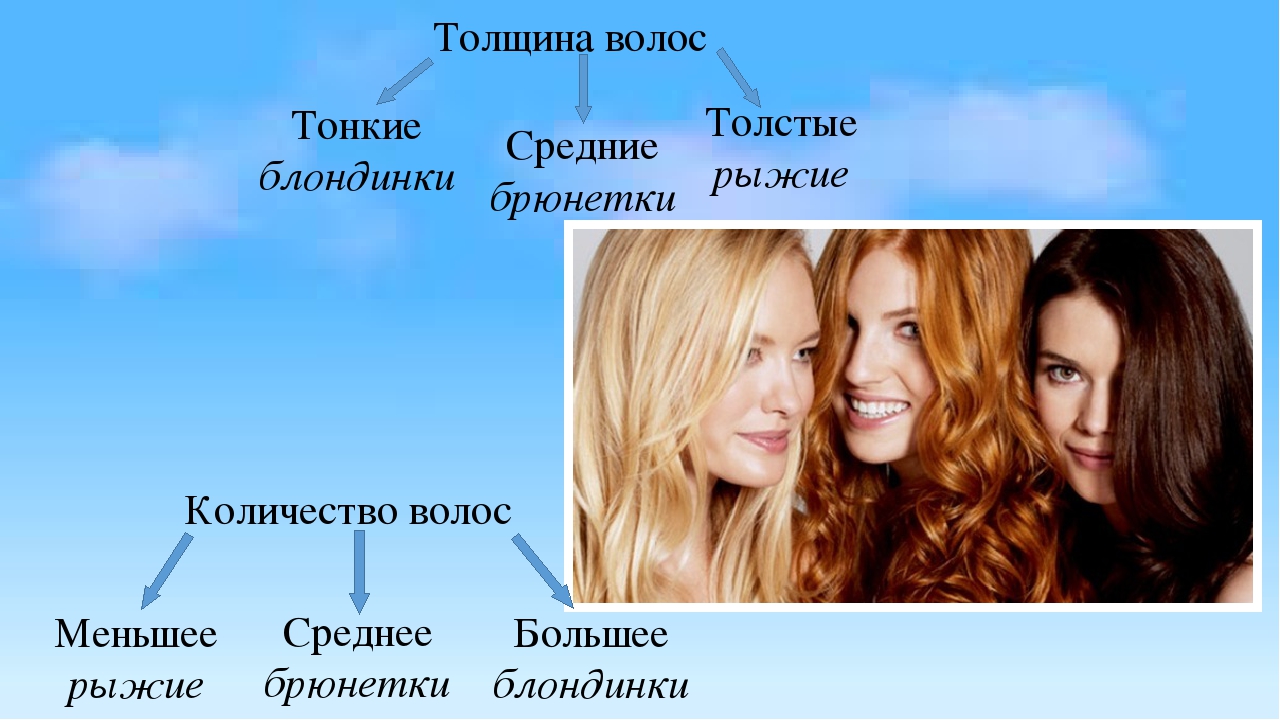
Факторы, отличные от генетики, также могут влиять на текстуру и толщину волос. Гормоны, некоторые лекарства и химические вещества, такие как средства для выпрямления волос или средства для химической завивки, могут изменить характеристики волос человека. Эти изменения могут быть временными или постоянными. Текстура и толщина волос также могут меняться с возрастом.
Фудзимото А., Кимура Р., Охаши Дж., Оми К., Юливуландари Р., Батубара Л., Мустофа М.С., Самаккарн У., Сеттитам-Исида В., Исида Т., Моришита Ю., Фурусава Т., Наказава М., Оцука Р., Токунага К. А. сканирование генетических детерминант морфологии человеческих волос: EDAR связан с азиатской толщиной волос. Хум Мол Жене. 2008 15 марта; 17 (6): 835-43. Epub 2007 Dec 8. PubMed: 18065779.
Fujimoto A, Nishida N, Kimura R, Miyagawa T, Yuliwulandari R, Batubara L, Mustofa MS, Samakkarn U, Settheetham-Ishida W, Ishida T, Morishita Y, Tsunoda T, Tokunaga K, Ohashi J. FGFR2 связан с толщиной волос у азиатского населения.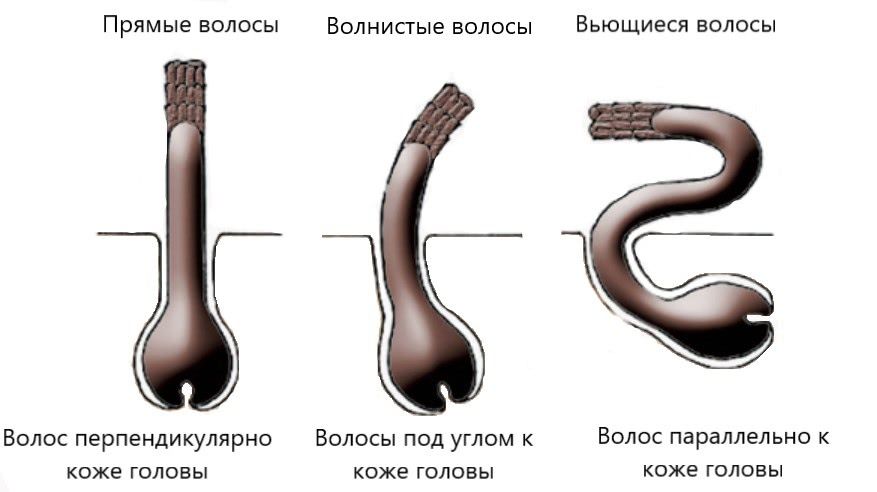 Джей Хам Жене. 2009 г.Авг; 54 (8): 461-5. doi: 10.1038/jhg.2009.61. Epub 2009 Jul 10. PubMed: 19590514.
Джей Хам Жене. 2009 г.Авг; 54 (8): 461-5. doi: 10.1038/jhg.2009.61. Epub 2009 Jul 10. PubMed: 19590514.
Medland SE, Nyholt DR, Painter JN, McEvoy BP, McRae AF, Zhu G, Gordon SD, Ferreira MA, Wright MJ, Henders AK, Campbell MJ, Duffy DL, Hansell NK, Макгрегор С., Слуцке В.С., Хит А.С., Монтгомери Г.В., Мартин Н.Г. Общие варианты гена трихогиалина связаны с прямыми волосами у европейцев. Am J Hum Genet. 2009 ноябрь; 85 (5): 750-5. doi: 10.1016/j.ajhg.2009.10.009. Epub 2009, 5 ноября. PubMed: 19896111. Бесплатный полный текст из PubMed Central: PMC2775823.
Симомура Ю., Кристиано А.М. Биология и генетика волос. Annu Rev Genomics Hum Genet. 2010;11:109-32. doi: 10.1146/annurev-genom-021610-131501. Обзор. ПабМед: 20590427.
Косметика | Бесплатный полнотекстовый | Известные и неизвестные особенности структуры кутикулы волос: краткий обзор
1. Введение
Кутикула волос жизненно важна для защиты внутренней структуры, коры, от повреждений, вызванных природными факторами окружающей среды, косметическими процедурами, промышленными процессами и изобретениями. из новых. Это несколько слоев в человеческом волосе (один слой в шерсти) из уплощенных перекрывающихся и физически твердых клеток, покрывающих кору волоса (рис. 1).
из новых. Это несколько слоев в человеческом волосе (один слой в шерсти) из уплощенных перекрывающихся и физически твердых клеток, покрывающих кору волоса (рис. 1).
Наружная ориентация краев клеток обеспечивает самоочищение от сплошного шелушения эпидермиса.
С момента изучения кутикулы волос первыми гистологами [1] появилось большое количество литературы. Здесь он кратко рассмотрен с соответствующими ссылками на наше понимание структуры кутикулы, достигнутое с помощью методов клеточной биологии. К ним относятся просвечивающая электронная микроскопия (ПЭМ), сканирующая ЭМ (СЭМ), рентгеновская фотоэлектронная спектроскопия (РФЭС), масс-спектроскопия вторичных ионов (ВИМС) и атомно-силовая микроскопия (АСМ) в сочетании с методами анализа белков. Исследования в течение примерно 70 лет выявили основные детали внутренней структуры клеток кутикулы. Важно также подчеркнуть, что все эти методы способствовали пониманию структуры и свойств волос в целом.
2.
 Три слоя в клетке кутикулы
Три слоя в клетке кутикулыВыдающейся особенностью являются три слоя, А-слой, экзокутикула и эндокутикула (рис. 2), которые впервые были выделены в ПЭМ по их электронной плотности и получены в соответствии с их относительным содержанием серы. Содержимое связывающих металлов окрашивает осмий, свинец и ртуть для ПЭМ [2,3].
Слой, ближайший к верхней поверхности каждой клетки кутикулы, представляет собой густо окрашенный А-слой, затем экзокутикулу и под ним эндокутикулу.
Во время роста волос и синтеза белка белки кутикулы и кортекса синтезируются с серой в восстановленном состоянии в виде остатков цистеина. Как следствие, красители металлов, осмиевая кислота, цитрат свинца и йодистая ртуть легко реагируют, увеличивая электронную плотность кератина и связанных с ним белков до тех пор, пока перекрестное связывание не произойдет примерно на половине пути вдоль фолликула, после чего окрашивание уменьшается. Исследование развивающихся клеток кутикулы с помощью ПЭМ [4,5] показало, что экзокутикула и А-слой развиваются как маленькие (тип 1) и крупные капли (тип 2) белка. Маленькие капли, по-видимому, являются предшественниками А-слоя, а более крупные — экзокутикулы (рис. 3).
Маленькие капли, по-видимому, являются предшественниками А-слоя, а более крупные — экзокутикулы (рис. 3).
Эти динамические события, отображаемые в ПЭМ как статические изменения, предполагают, что более мелкие капли образуют самый внешний А-слой. Они мигрируют и агрегируют, в том числе с кератиновыми филаментами, с образованием аморфного А-слоя под внешней плазматической мембраной клетки. Более крупные капли как предшественники экзокутикулы увеличиваются в размерах, они также мигрируют наружу, образуя слой сложных пластинок. В некоторых ориентациях в пластинках различим редкий центральный более плотный слой (рис. 4) [6], что позволяет предположить, что некоторый плотный белок А-слоя включен в пластинки экзокутикулы. Здесь есть пробел в наших знаниях, потому что нет TEM, показывающих развитие этого события.
В конце концов эти структуры примыкают к А-слою и сливаются с ним, образуя однородную массу, экзокутикулу (рис. 5).
Важным открытием в этих процессах стало присутствие жирных кислот, ковалентно связанных с поверхностью кутикулы. Они включают стеариновую и пальмитиновую кислоты, но особенно необычную жирную кислоту с разветвленной цепью, антеизо-18-метилэйкозановую кислоту (18-МЭА) [7,8,9]. Это открытие объяснило гидрофобные свойства поверхности волос. Согласно лучшим данным, 18-МЭА может составлять до 70% ковалентно связанных жирных кислот, полностью покрывающих поверхность волокна. Преобладание 18-МЭА по отношению к жирным кислотам с прямой цепью указывает на особую функцию, такую как стабильность гидрофобной поверхности или влияние на трение на поверхности, но ответы на эти вопросы требуют дальнейших исследований. Жирные кислоты присоединены тиоэфирными связями [9] к белковой подложке, еще предстоит точно идентифицировать. Толщина поверхностного липида 18-МЭА оценивалась в 0,9 нм [10], а с помощью ПЭМ он также отображался как «нечеткий» поверхностный слой [11]. Молекулы МЭА длиннее гидрофобного слоя и могут быть свернуты для размещения в пространстве 0,9 нм [12].
Они включают стеариновую и пальмитиновую кислоты, но особенно необычную жирную кислоту с разветвленной цепью, антеизо-18-метилэйкозановую кислоту (18-МЭА) [7,8,9]. Это открытие объяснило гидрофобные свойства поверхности волос. Согласно лучшим данным, 18-МЭА может составлять до 70% ковалентно связанных жирных кислот, полностью покрывающих поверхность волокна. Преобладание 18-МЭА по отношению к жирным кислотам с прямой цепью указывает на особую функцию, такую как стабильность гидрофобной поверхности или влияние на трение на поверхности, но ответы на эти вопросы требуют дальнейших исследований. Жирные кислоты присоединены тиоэфирными связями [9] к белковой подложке, еще предстоит точно идентифицировать. Толщина поверхностного липида 18-МЭА оценивалась в 0,9 нм [10], а с помощью ПЭМ он также отображался как «нечеткий» поверхностный слой [11]. Молекулы МЭА длиннее гидрофобного слоя и могут быть свернуты для размещения в пространстве 0,9 нм [12].
Эндокутикула, по сравнению с экзокутикулой, представляет собой совершенно другой слой, рыхлую аморфную массу, представляющую собой цитоплазматические остатки белка, за исключением присутствия кальций-связывающего белка S100E [13]. Его функция неизвестна.
Его функция неизвестна.
3. Эпикутикула
Эпикутикула была первой субструктурой кутикулы, которая была изучена в ПЭМ [14]. Ее открытие произошло при обработке волос или шерсти насыщенной хлором водой и было названо реакцией Олвордена [15] по имени автора, впервые описавшего ее. Известно, что хлор снижает фрикционные свойства шерсти; его эффект заключается в образовании микроскопических мембранных пузырьков на поверхности, но не разрушает структуру волокна. Эпикутикула представляет собой производную мембранную структуру, толщина которой оценивается в 50–70 нм. Первоначально считалось, что эпикутикула покрывает только поверхность волоса. Дальнейшие исследования показали, что он полностью окружает поверхность отдельных клеток кутикулы [16]. Происхождение его состава неизвестно. В основном это белок [17], а ковалентно связанные липиды, в основном 18-МЭА, отщепляются от поверхности хлором [9].]. Считается, что А-слой задействован из-за содержания серы, которая может обеспечить сульфгидрильные группы для ковалентного закрепления жирных кислот. Толщина А-слоя непостоянна, поэтому, если бы он полностью отделился от экзокутикулы, его вклад в толщину эпикутикулы от шерсти составил бы порядка 70 нм [5]. Измерения толщины эпикутикулы дали значение 5 нм [12], и при таком значении могла быть вовлечена только часть А-слоя. Стабильность белка эпикутикулы к сильнодействующим реагентам связывают с перекрестным связыванием изопептидов [6]. Это не обязательно так, потому что белки внутреннего корневого влагалища и сердцевины имеют высокое содержание изопептидов и тем не менее расщепляются протеазами до пептидов [18,19].,20]. Более вероятно, что устойчивость к деградации является результатом совместных сил водородных связей, дисульфидных связей и изопептидных поперечных связей в структуре бета-гофрированного листа.
Толщина А-слоя непостоянна, поэтому, если бы он полностью отделился от экзокутикулы, его вклад в толщину эпикутикулы от шерсти составил бы порядка 70 нм [5]. Измерения толщины эпикутикулы дали значение 5 нм [12], и при таком значении могла быть вовлечена только часть А-слоя. Стабильность белка эпикутикулы к сильнодействующим реагентам связывают с перекрестным связыванием изопептидов [6]. Это не обязательно так, потому что белки внутреннего корневого влагалища и сердцевины имеют высокое содержание изопептидов и тем не менее расщепляются протеазами до пептидов [18,19].,20]. Более вероятно, что устойчивость к деградации является результатом совместных сил водородных связей, дисульфидных связей и изопептидных поперечных связей в структуре бета-гофрированного листа.
4. Комплекс клеточных мембран (CMC)
Интересным аспектом структуры кутикулы является изменение плазматических мембран между клетками кутикулы (и границами кутикулы и коры) в процессе развития кутикулы во время роста волос. Это изменение было предметом обширных отчетов и обзоров [21,22]. Очень мало известно об их образовании и составе, и большая часть наших знаний получена из исследований кератинизированных волос или шерсти с помощью ПЭМ [22], а также АСМ [23]. Межклеточная мембрана ранней кутикулы представляет собой типичную трехслойную мембрану, состоящую из билипидного слоя, окруженного белковыми слоями, и межклеточного пространства между соседними клетками. Однако на более поздних стадиях роста волос разделение почти ороговевших клеток кутикулы происходит с участием совсем другой структуры — комплекса клеточной мембраны. Центральный более плотный слой, δ-слой, предположительно белковый, развивается между соседними клетками кутикулы и окружен двумя β-слоями низкой плотности, каждый из которых интерпретируется как билипидный слой (рис. 6).
Это изменение было предметом обширных отчетов и обзоров [21,22]. Очень мало известно об их образовании и составе, и большая часть наших знаний получена из исследований кератинизированных волос или шерсти с помощью ПЭМ [22], а также АСМ [23]. Межклеточная мембрана ранней кутикулы представляет собой типичную трехслойную мембрану, состоящую из билипидного слоя, окруженного белковыми слоями, и межклеточного пространства между соседними клетками. Однако на более поздних стадиях роста волос разделение почти ороговевших клеток кутикулы происходит с участием совсем другой структуры — комплекса клеточной мембраны. Центральный более плотный слой, δ-слой, предположительно белковый, развивается между соседними клетками кутикулы и окружен двумя β-слоями низкой плотности, каждый из которых интерпретируется как билипидный слой (рис. 6).
Исследование мембранного комплекса кутикулы волос с помощью ПЭМ у субъектов с мутацией пути синтеза 18-MEA (болезнь мочи с кленовым сиропом (MSUD) [24] показало, что вероятное положение MEA находится только на одном лице, Верхняя поверхность каждой клетки кутикулы. Именно этот поверхностный слой 18-МЭА и других жирных кислот отвечает за гидрофобную поверхность волокна (рис. 7). Джонс предложил, как расщепляется КМЦ, обнажая нижележащий липид [6]. Какие свойства 18-МЭА обеспечивают волосы, неясно, но было высказано предположение, что, поскольку 18-МЭА имеет разветвленную цепь, температура плавления намного ниже, чем у прямой цепи, и, как следствие, липидный слой на поверхности кутикулы будет быть более текучим, что может изменить фрикционные свойства.0011
Именно этот поверхностный слой 18-МЭА и других жирных кислот отвечает за гидрофобную поверхность волокна (рис. 7). Джонс предложил, как расщепляется КМЦ, обнажая нижележащий липид [6]. Какие свойства 18-МЭА обеспечивают волосы, неясно, но было высказано предположение, что, поскольку 18-МЭА имеет разветвленную цепь, температура плавления намного ниже, чем у прямой цепи, и, как следствие, липидный слой на поверхности кутикулы будет быть более текучим, что может изменить фрикционные свойства.0011
5. Обсуждение: некоторые неизвестные аспекты структуры кутикулы, для разрешения которых требуются инновационные методы
Экзокутикула :
Образование капель предшественника экзокутикулы, их слияние и миграция на внешнюю поверхность — увлекательные процессы. Любое исследование этого должно также объяснить отчетливое развитие А-слоя со значительно более высоким содержанием цистина. Капли образуются в результате самоагрегации белковых компонентов. Для изучения этой возможности потребуется подготовка этих белков. Известно, что только KAP5 и KAP10 являются основными компонентами, поэтому для идентификации других необходим дополнительный анализ белков экзокутикулы. Последовательности генов известны для KAP5 и KAP10 и могут быть получены путем экспрессии в бактериальных системах. Изучение их взаимодействия тогда можно было бы проводить стандартными методами протеомики, такими как те, которые используются при изучении связывания КАР с кератином IF [25]. Однако миграционный аспект более сложен для изучения, поскольку это динамическое событие. Может ли он управляться путем микротрубочек? Нет отчета, указывающего на их участие, поэтому было бы полезно тщательное исследование ПЭМ на многих уровнях фолликулов с использованием иммунохимического отслеживания.
Известно, что только KAP5 и KAP10 являются основными компонентами, поэтому для идентификации других необходим дополнительный анализ белков экзокутикулы. Последовательности генов известны для KAP5 и KAP10 и могут быть получены путем экспрессии в бактериальных системах. Изучение их взаимодействия тогда можно было бы проводить стандартными методами протеомики, такими как те, которые используются при изучении связывания КАР с кератином IF [25]. Однако миграционный аспект более сложен для изучения, поскольку это динамическое событие. Может ли он управляться путем микротрубочек? Нет отчета, указывающего на их участие, поэтому было бы полезно тщательное исследование ПЭМ на многих уровнях фолликулов с использованием иммунохимического отслеживания.
Эпикутикула
Аминокислотные анализы показали наличие остатков цистеина, обеспечивающих закрепление жирных кислот (связи расщепляются хлорированием для образования эпикутикулы). Что касается происхождения белков, то имеются убедительные доказательства, указывающие на участие А-слоя [26]. Однако возможно, что белки из комплекса клеточной мембраны, составляющие межклеточный цемент, также участвуют. В попытке найти белки, к которым 18-МЭА и другие жирные кислоты присоединены тиоэфирными связями, были проведены эксперименты на волокнах до кератинизации (G. Rogers and K. Koike, неопубликованные данные). При использовании этого подхода кератиновые структуры не были сшиты и лучше поддавались исследованиям в растворе. Ожидалось, что белки, такие как комплекс клеточной мембраны, будут присутствовать в небольшом количестве, поэтому мы столкнулись с количественной проблемой. Следовательно, мы использовали эпилированные фолликулы из овчины; можно получить тысячи фолликулов в фазе анагена. Их белки солюбилизировали 8М мочевиной, а SH-группы блокировали йодацетамидом. В обширных исследованиях авторы использовали несколько различных методов для идентификации любых белков с жирными кислотами, ковалентно связанными с цистеинильными группами. Наиболее прямой метод заключался в том, чтобы пометить ацилированные сайты с помощью ацил-биотинового обмена [27].
Однако возможно, что белки из комплекса клеточной мембраны, составляющие межклеточный цемент, также участвуют. В попытке найти белки, к которым 18-МЭА и другие жирные кислоты присоединены тиоэфирными связями, были проведены эксперименты на волокнах до кератинизации (G. Rogers and K. Koike, неопубликованные данные). При использовании этого подхода кератиновые структуры не были сшиты и лучше поддавались исследованиям в растворе. Ожидалось, что белки, такие как комплекс клеточной мембраны, будут присутствовать в небольшом количестве, поэтому мы столкнулись с количественной проблемой. Следовательно, мы использовали эпилированные фолликулы из овчины; можно получить тысячи фолликулов в фазе анагена. Их белки солюбилизировали 8М мочевиной, а SH-группы блокировали йодацетамидом. В обширных исследованиях авторы использовали несколько различных методов для идентификации любых белков с жирными кислотами, ковалентно связанными с цистеинильными группами. Наиболее прямой метод заключался в том, чтобы пометить ацилированные сайты с помощью ацил-биотинового обмена [27]. Эта процедура заключалась в инкубации белков, растворимых в мочевине, заблокированных йодацетамидом, с гидроксиламином при 20 °C, который специфически разрывает тиоэфирные связи и высвобождает жирные кислоты. Затем любые открытые SH-группы белка метили фрагментом биотина, а любые белки, помеченные биотином, захватывали стрептавидиновыми гранулами. Несвязанные белки удаляли промыванием, а любые связанные белки высвобождали из шариков. После концентрирования элюатов белки исследовали с помощью гель-электрофореза. Контроли для экспериментов были идентичными, но без стадии гидроксиламина. После нескольких попыток мы не смогли получить последовательных результатов. Мы подозреваем, что это было вызвано неожиданной проблемой с методом. Мы обнаружили, что гидроксиламин в присутствии 8 М мочевины образовывал гель, который мог прервать гидролиз. Гелеобразование происходило в отсутствие белка, и в литературе не было найдено объяснения. Эти эксперименты по обмену ацил-биотина необходимо повторить, но с использованием других хаотропных агентов для замены мочевины, таких как тиоцианат гуанидина или соли лития, чтобы избежать явления гелеобразования, но сохранить белки в растворе.
Эта процедура заключалась в инкубации белков, растворимых в мочевине, заблокированных йодацетамидом, с гидроксиламином при 20 °C, который специфически разрывает тиоэфирные связи и высвобождает жирные кислоты. Затем любые открытые SH-группы белка метили фрагментом биотина, а любые белки, помеченные биотином, захватывали стрептавидиновыми гранулами. Несвязанные белки удаляли промыванием, а любые связанные белки высвобождали из шариков. После концентрирования элюатов белки исследовали с помощью гель-электрофореза. Контроли для экспериментов были идентичными, но без стадии гидроксиламина. После нескольких попыток мы не смогли получить последовательных результатов. Мы подозреваем, что это было вызвано неожиданной проблемой с методом. Мы обнаружили, что гидроксиламин в присутствии 8 М мочевины образовывал гель, который мог прервать гидролиз. Гелеобразование происходило в отсутствие белка, и в литературе не было найдено объяснения. Эти эксперименты по обмену ацил-биотина необходимо повторить, но с использованием других хаотропных агентов для замены мочевины, таких как тиоцианат гуанидина или соли лития, чтобы избежать явления гелеобразования, но сохранить белки в растворе.
6. На какой стадии роста волос 18-МЭА прикрепляется к кутикуле и как это происходит?
Синтез 18-МЭА происходит в печени, он циркулирует в крови и доступен для захвата и ферментативного переноса на тиоловые группы предположительно ферментом трансферазой. Известное местонахождение 18-МЭА в волосах — на верхней поверхности уплощенных клеток кутикулы. Эта асимметрия как структурная особенность β-слоя и вопрос о том, как происходит присутствие 18-МЭА, прикрепленного только к одной грани, любопытны и остаются без объяснения.
Мы не знаем, на каком уровне фолликула 18-MEA связывается с белком кутикулы, но это должно происходить, когда белки имеют сульфгидрильные группы, доступные для ацилирования жирными кислотами; область, определяемая как зона удлинения фолликула [4], начинается проксимальнее волосяной луковицы.
Одним из возможных методов локализации этих событий может быть использование ПЭМ-авторадиографии. Для этого потребуется инъекция достаточного количества тритированного 18-МЕА мышам или молодым морским свинкам, предпочтительно последним, поскольку большинство фолликулов находятся в анагене. По прошествии определенного времени биопсии кожи будут взяты, обработаны, подвергнуты авторадиографическому обнаружению и исследованы в ПЭМ. Проблема здесь в том, что тритий или C 14 с маркировкой 18-MEA не продаются. Тем не менее, они могут быть синтезированы для этой цели. Углерод-14 можно использовать для авторадиографии на уровне ПЭМ, но он менее эффективен, чем тритий.
По прошествии определенного времени биопсии кожи будут взяты, обработаны, подвергнуты авторадиографическому обнаружению и исследованы в ПЭМ. Проблема здесь в том, что тритий или C 14 с маркировкой 18-MEA не продаются. Тем не менее, они могут быть синтезированы для этой цели. Углерод-14 можно использовать для авторадиографии на уровне ПЭМ, но он менее эффективен, чем тритий.
7. Резюме
Теперь у нас есть полное представление о структуре клеток кутикулы волоса в результате применения ряда физических и химических методов. Сила ТЕМ сыграла центральную роль из-за крошечной природы волосяного фолликула и макромолекулярных компонентов волос. В этом эссе обсуждались некоторые оставшиеся без ответа вопросы, и очевидно, что они представляют фундаментальный интерес, но их будет трудно решить, и, несомненно, потребуются новые подходы. Обоснование будущих исследований в этом направлении, вероятно, во многом будет зависеть от применимости дальнейших знаний к использованию и лечению волос.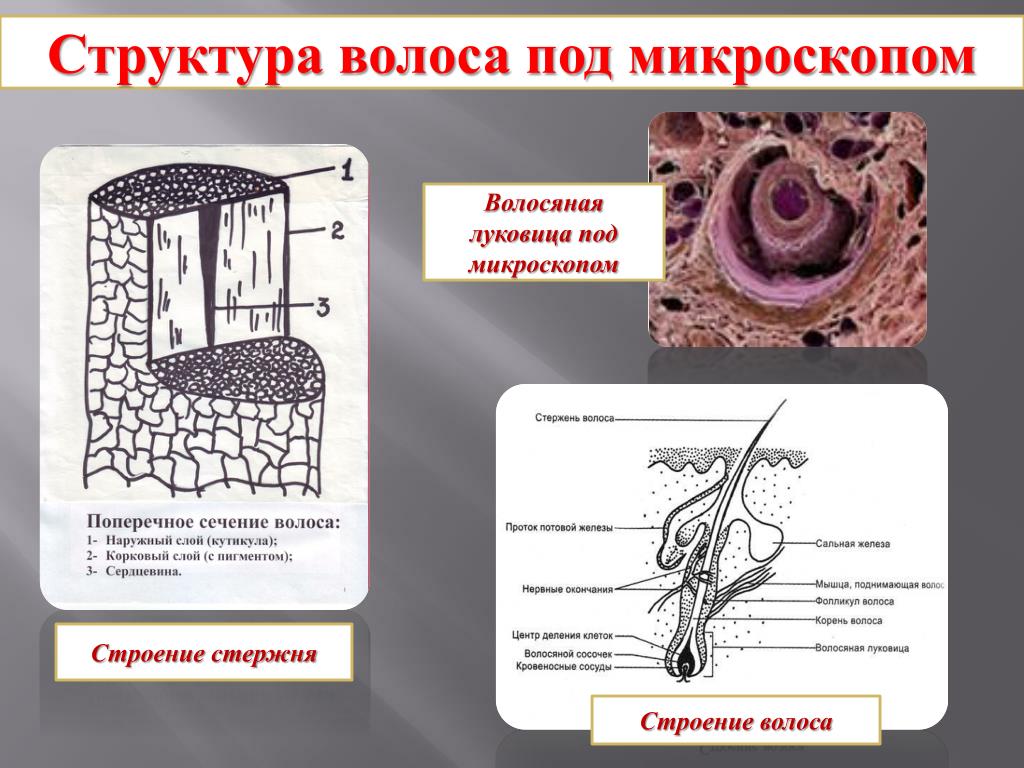
Финансирование
Подготовка этого обзора не финансировалась извне. Автор выражает признательность за предоставление письменных принадлежностей Департаментом молекулярных и биомедицинских наук.
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов.
Ссылки
- Auber, L. Анатомия фолликулов, производящих шерстяные волокна, с особым упором на кератинизацию. Транс. Р. Соц. Эдинб. 1951 , 62 ч. 1, 191–254. [Академия Google] [CrossRef]
- Роджерс, Г.Э. Электронно-микроскопические исследования волос и шерсти. Анна. Н. Я. акад. науч. 1959 , 83, 378–399. [Google Scholar] [CrossRef] [PubMed]
- Rogers, G.E. Электрон. микроскопия шерсти. Дж. Ультраструктур. Рез. 1959 , 2, 309–330. [Google Scholar] [CrossRef]
- Вудс, Л.Дж.; Орвин, Д.Ф.Г. Исследования поверхностных слоев кутикулы шерстяного волокна. Волокнистые белки: научные, медицинские и промышленные аспекты; Парри, Д.
 А.Д., Кример, Л.К., ред.; Академическая пресса: Лондон, Великобритания, 1980; стр. 141–150. [Google Scholar]
А.Д., Кример, Л.К., ред.; Академическая пресса: Лондон, Великобритания, 1980; стр. 141–150. [Google Scholar] - Орвин, Д.Ф.Г. Цитология и цитохимия шерстяного фолликула. Междунар. Преподобный Цитол. 1979 , 60, 331–374. [Google Scholar]
- Джонс, Л.Н. Поверхность волосяного волокна. В коже, волосах и ногтях; Форслинд, Б., Линдберг, М., ред.; CRC: Бока-Ратон, Флорида, США, 2003 г.; стр. 285–316. [Google Scholar]
- Эванс, Д.Дж.; Лидер, JD; Риппон, Дж. А.; Риветт, Д.Э. Разделение и анализ поверхностных липидов шерстяного волокна. В материалах 7-й Международной конференции по исследованию шерстяного текстиля, Токио, Япония, 28 августа – 3 сентября 19 г.85; стр. 181–193. [Google Scholar]
- Негри, А.П.; Корнелл, HJ; Риветт, Д.Э. Природа ковалентно связанных жирных кислот в шерстяных волокнах. Ауст. Дж. Агрик. Рез. 1991 , 42, 1285–1292. [Google Scholar] [CrossRef] «> Негри, А.П.; Корнелл, HJ; Риветт, Д.Э. Модель поверхности кератиновых волокон. Текст. Рез. J. 1993 , 63, 109–115. [Google Scholar] [CrossRef]
- Ward, RJ; Уиллис, HA; Джордж, Джорджия; Гиз, Великобритания; Деннинг, Р.Дж.; Эванс, ди-джей; Шорт, Р. Д. Анализ поверхности шерсти с помощью рентгеновской фотоэлектронной спектроскопии и масс-спектрометрии вторичных ионов. Текст. Рез. Дж. 1993 , 63, 362–368. [Google Scholar] [CrossRef]
- Jones, NL; Риветт, Д.Э. Роль 18-метилэйкозановой кислоты в структуре и формировании волосяных волокон млекопитающих. Микрон 1997 , 28, 469–485. [Google Scholar] [CrossRef]
- Zahn, H.; Мессингер, Х .; Хокер, Х. Ковалентно связанные жирные кислоты на поверхности шерсти: часть «оболочки клеток кутикулы». Текст. Рез. J. 1994 , 64, 554–555. [Google Scholar] [CrossRef]
- Кизава, К.; Учива, Х .; Мураками, У. Высоко экспрессированный S100A3, кальций-связывающий белок в кутикуле человеческого волоса.
 Биохим. Биофиз. Акта 1996 , 13, 94–98. [Google Scholar] [CrossRef]
Биохим. Биофиз. Акта 1996 , 13, 94–98. [Google Scholar] [CrossRef] - Линдберг, Дж.; Филип, Б.; Грален Н. Возникновение тонких мембран в структуре шерсти. Nature 1948 , 162, 458. [Google Scholar] [CrossRef]
- von Allworden, K. Свойства шерсти и новый химический метод обнаружения поврежденной шерсти. Ангью. хим.
- Bradbury, HJ; Лидер, Дж. Д. Кератиновые волокна. IV. Строение кутикулы. Ауст. Дж. Биол. науч. 1970 , 23, 843–854. [Google Scholar] [CrossRef] [PubMed]
- King, R.N.L.; Брэдбери, Дж. Х. Химический состав шерсти. V: Эпикутикула. Ауст. Дж. Биол. науч. 1968 , 21, 375–384. [Google Scholar] [CrossRef]
- Rogers, GE; Хардинг, HWJ; Ллевеллин-Смит, И.Дж. Происхождение цитруллинсодержащих белков в волосяном фолликуле и химическая природа трихогиалина, внутриклеточного предшественника.
 Биохим. Биофиз. Acta 1977 , 495, 159–175. [Академия Google] [CrossRef]
Биохим. Биофиз. Acta 1977 , 495, 159–175. [Академия Google] [CrossRef] - Роджерс, Г.Э. Некоторые наблюдения над белками клеток внутреннего корневого влагалища волосяных фолликулов. Биохим. Биофиз. Acta 1958 , 29, 33–43. [Google Scholar] [CrossRef]
- Rogers, G.E. Новые данные о ферментах и белках волосяных фолликулов. Анна. Н. Я. акад. науч. 1959 , 83, 408–428. [Google Scholar] [CrossRef]
- Leeder, J.D. Wool-Nature’s Wonder Fibre; Australasian Textile Publishers: Ocean Grove, Australia, 1984. [Google Scholar]
- Джонс, Л.Н.; Ужас, Т.Дж.; Каплин, И.Ю. Формирование поверхностных мембран в развивающихся волосяных волокнах млекопитающих. Микрон 1994 , 25, 589–595. [Google Scholar] [CrossRef]
- Swift, AJ; Бьюз, Б. Химия кутикулы человеческого волоса-II: выделение и анализ аминокислот клеточных мембран и А-слоя. Дж. Соц.
 Космет. хим. 1974 , 25, 355–366. [Google Scholar]
Космет. хим. 1974 , 25, 355–366. [Google Scholar] - Джонс, Л.Н.; Пит, ди-джей; Данкс, Д.М.; Негри, А.П.; Риветт, Д.Э. Волосы от пациентов с болезнью мочи кленового сиропа показывают структурный дефект в кутикуле волокна. Дж. Расследование. Дерматол. 1996 , 106, 461–464. [Google Scholar] [CrossRef] [PubMed]
- Fujikawa, H.; Фудзимото, А .; Фарук, М .; Ито, М.; Шимомура, Ю. Характеристика семейства кератин-ассоциированных белков 10, специфичных для кутикулы стержня волоса человека. Дж. Расследование. Дерматол. 2013 , 133, 2780–2782. [Google Scholar] [CrossRef] [PubMed]
- Бринганс, С.Д.; Пахарь, Дж. Э.; Дайер, Дж. М.; Клеренс, С.; Вернон, Дж. А.; Брайсон, В. Г. Характеристика белков а-слоя экзокутикулы шерсти. Эксп. Дерматол. 2007 , 16, 951–960. [Google Scholar] [CrossRef] [PubMed]
- Дрисдел, Ч.Р.; Грин, В. Н. Маркировка и количественная оценка сайтов пальмитоилирования белков.
 Биотехнологии 2004 , 36, 276–285. [Google Scholar] [CrossRef] [PubMed]
Биотехнологии 2004 , 36, 276–285. [Google Scholar] [CrossRef] [PubMed]
Рисунок 1. ( a ) SEM шерстяного волокна ×1500; ( b ) СЭМ волосяного волокна ×400.
Рисунок 1. ( a ) SEM шерстяного волокна ×1500; ( b ) СЭМ волосяного волокна ×400.
Рисунок 2. ПЭМ поперечного сечения человеческого волоса с пятью перекрывающимися клетками кутикулы. Каждая клетка имеет плотный А-слой и менее плотную экзокутикулу под ним. Нижний слой — эндокутикула. ×35 000.
Рисунок 2. ПЭМ поперечного сечения человеческого волоса с пятью перекрывающимися клетками кутикулы. Каждая клетка имеет плотный А-слой и менее плотную экзокутикулу под ним. Нижний слой — эндокутикула. ×35 000.
Рисунок 3. Ранняя стадия f формирования А-слоя и экзокутикулы, показывающая, как капли типа 1 мигрируют к клеточной мембране и смешиваются с филаментами (черная стрелка). Ближайшие более крупные капли типа 2 находятся в цитоплазме (стрелки). Из ссылки [4].
Из ссылки [4].
Рисунок 3. Ранняя стадия f формирования А-слоя и экзокутикулы, показывающая, как капли типа 1 мигрируют к клеточной мембране и смешиваются с филаментами (черная стрелка). Ближайшие более крупные капли типа 2 находятся в цитоплазме (стрелки). Из ссылки [4].
Рисунок 4. Поздняя стадия формирования экзокутикулы (экзо) в клетке кутикулы (ККУ), примыкающей к клетке внутреннего корневого влагалища (ВРККУ) и отделенной межклеточным слоем ККМ (МКС). Обратите внимание на внутреннее темное напряжение в пластинке экзокутикулы, которое может быть белком А-слоя. Эта стадия заметно отличается от представленной на рис. 3. Предоставлено доктором Л. Джонсом.
Рисунок 4. Поздняя стадия формирования экзокутикулы (экзо) в клетке кутикулы (ККУ), примыкающей к клетке внутреннего корневого влагалища (ВРККУ) и отделенной межклеточным слоем ККМ (МКС). Обратите внимание на внутреннее темное напряжение в пластинке экзокутикулы, которое может быть белком А-слоя. Эта стадия заметно отличается от представленной на рис. 3. Предоставлено доктором Л. Джонсом.
Эта стадия заметно отличается от представленной на рис. 3. Предоставлено доктором Л. Джонсом.
Рисунок 5. Клетка кутикулы шерстяного волокна с почти полным уплотнением экзокутикулы (ех) и более плотным А-слоем на поверхности (стрелки). Из ссылки [4].
Рисунок 5. Клетка кутикулы шерстяного волокна с почти полным уплотнением экзокутикулы (ех) и более плотным А-слоем на поверхности (стрелки). Из ссылки [4].
Рисунок 6. Комплекс клеточной мембраны между двумя клетками кутикулы, показывающий центральный плотный δ-слой и окруженный двумя β-слоями низкой плотности. Из ссылки [24].
Рисунок 6. Комплекс клеточной мембраны между двумя клетками кутикулы, показывающий центральный плотный δ-слой и окруженный двумя β-слоями низкой плотности. Из ссылки [24].
Рисунок 7. Комплекс клеточной мембраны в волосах с болезнью кленового сиропа, показывающий разрушение β-слоя на верхней поверхности каждой клетки кутикулы (FCU).
 А.Д., Кример, Л.К., ред.; Академическая пресса: Лондон, Великобритания, 1980; стр. 141–150. [Google Scholar]
А.Д., Кример, Л.К., ред.; Академическая пресса: Лондон, Великобритания, 1980; стр. 141–150. [Google Scholar]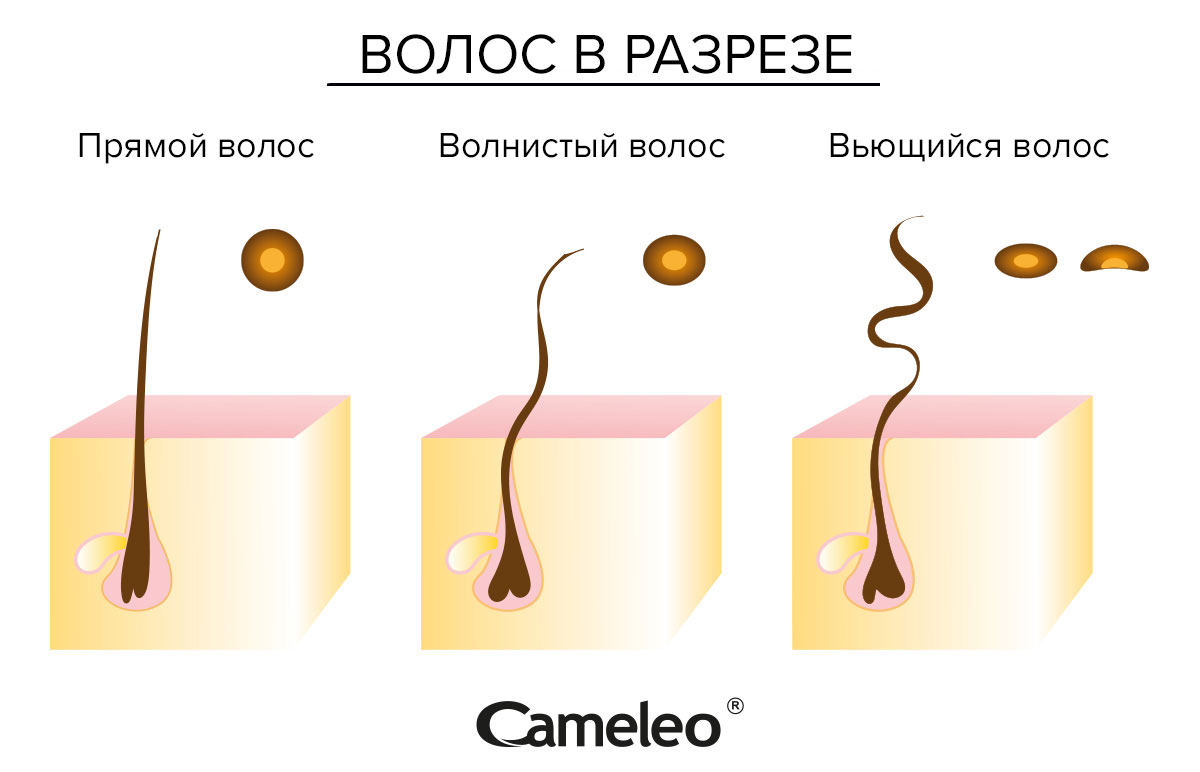 Биохим. Биофиз. Акта 1996 , 13, 94–98. [Google Scholar] [CrossRef]
Биохим. Биофиз. Акта 1996 , 13, 94–98. [Google Scholar] [CrossRef] Биохим. Биофиз. Acta 1977 , 495, 159–175. [Академия Google] [CrossRef]
Биохим. Биофиз. Acta 1977 , 495, 159–175. [Академия Google] [CrossRef] Космет. хим. 1974 , 25, 355–366. [Google Scholar]
Космет. хим. 1974 , 25, 355–366. [Google Scholar] Биотехнологии 2004 , 36, 276–285. [Google Scholar] [CrossRef] [PubMed]
Биотехнологии 2004 , 36, 276–285. [Google Scholar] [CrossRef] [PubMed]