Химическое строение волоса
Химическое строение волос достаточно сложное, как уже упоминалось ранее волос состоит из белка, который растет из клеток внутри волосяного фолликула. Как только образуются живые клетки внутри волоса, они начинают свой путь вверх через волосяной фолликул. Вновь образованные клетки волоса созревают и при этом наполняются волокнистым белком, который носит название кератин. Данный процесс созревания — ороговение или кератинизация. После того, как клетки наполняются кератином, они продвигаются вверх, при этом теряют ядро и умирают. К тому времени как волос выходит наружу из фолликула клетки волоса уже полностью ороговели и не являются живыми.
Волосы состоят на 90% из белка — кератина. Белок состоит из длинных цепей аминокислот, которые в свою очередь состоят из химических элементов. Основными химическими элементами, из которых состоит человеческий волос являются: углерод, кислород, водород, азот и сера. Из этих элементов так же состоят кожа и ногти.
Процентное содержание в нормальном волосе
Углерод — 51%
Кислород — 21%
Водород — 6%
Азот — 17%
Сера — 5%
Цепочка кератина
Белки состоят из длинных цепочек аминокислот, которые соединились друг с другом как цепочки бисера. Сильная химическая связь, которая соединяет аминокислоты между собой носит название — белковой или полипептидной. Белки — это длинные, спиральные сложные аминокислотные цепочки, соединенные белковыми связями. Белковые цепочки кератина переплетаются друг с другом и образуют гибкую спираль. Именно такая сложная структура кератина делает его прочным.
Кортекс волоса состоит из миллионов сложных белковых цепочек. Эти цепи сшиты как ступеньки на лестнице несколькими типами дополнительных боковых связей. Именно они связывают цепочки кератина вместе и отвечают за сильную прочность и хорошую эластичность человеческого волоса.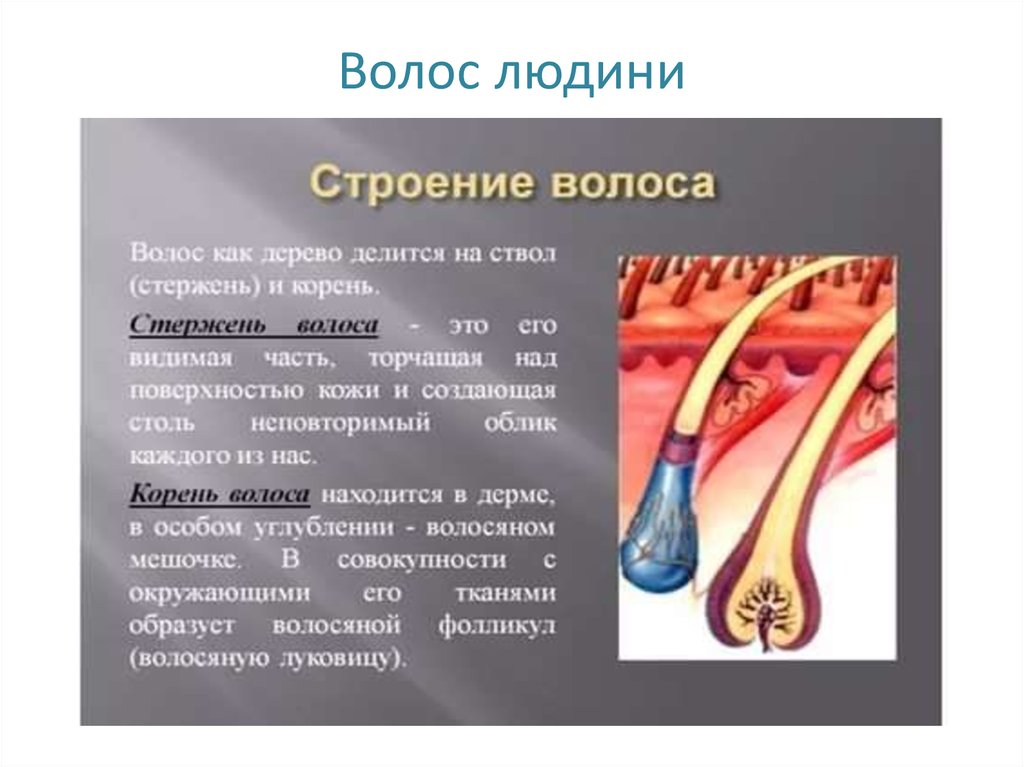
Химические связи в волосах
Водородная связь является очень слабой физической поперечной связью, которая легко разрушается водой и температурой. И хотя по отдельности водородные связи очень слабые, но их в волосах так много, что на их долю приходиться около одной трети от общей численности связей в волосах. Водородные связи легко разрушаются при намокании волос. Это позволяет волосам легко растягиваться. При высыхании волоса водородные связи восстанавливаются и фиксируют форму волос в том положении в котором волосы оказались.
Ионные или солевые связи так же являются слабыми физическими связями, образующимися поперек волоса между соседними белковыми цепочками. Ионные связи зависят от pH на волосах, поэтому они легко разрушаются сильными щелочными и кислыми растворами.
Дисульфидная связь — это сильная химическая связь, которая очень отличается от физических водородной и ионной. Она соединяет атомы серы двух соседних аминокислот цистеина, что бы создать одну — цистин. Цистин объединяет две белковые цепочки в единое целое.
Хотя самих дисульфидных связей гораздо меньше, чем водородных и ионных, но они очень сильные и не разрушаются водой. Разорвать дисульфидную связь можно с помощью препаратов для химической завивки и выпрямления. Мало того нормальное температурное воздействие, как, например, при термоукладке, не разрушают дисульфидных связей. Однако очень сильные воздействия температуры, как при воздействии кипятка и некоторых высокотемпературных инструментов для укладки, нарушают эти связи. Яркий пример такого сильного воздействия — утюжки для выпрямления волос.
Большинство препаратов для химической завивке и выпрямлении на украинском рынке вызывают разрушение дисульфидные связи с возможностью дальнейшего восстановления с помощью нейтрализаторов или фиксажа. Однако, все еще на зарубежных рынках, таких как Европа, Америка и т. п. Можно встретить специальные препараты для химического выпрямления, которые разламывают дисульфидные связи без возможности их дальнейшего восстановления.
Однако, все еще на зарубежных рынках, таких как Европа, Америка и т. п. Можно встретить специальные препараты для химического выпрямления, которые разламывают дисульфидные связи без возможности их дальнейшего восстановления.
Химический состав
Или, с чем мы имеем дело?
Волосы состоят в основном из кератина – белка, построенного из аминокислот. Аминокислоты являются строительным материалом для роста волос.
Примерный химический состав здорового волос таков: 78% белка, 15% вода, 6% липидов, 1% пигмента.
Незаменимые аминокислоты и другие питательные вещества поступают в наш организм с пищей. Они разносятся по всему телу кровотоком и по капиллярам, так они достигают волосяного сосочка. Вот почему долгий путь к здоровым волосам и здоровой коже лежит через соблюдение правильного сбалансированного режима питания.
Большое количество аминокислот, соединяясь между собой, образуют полипептидную цепь.
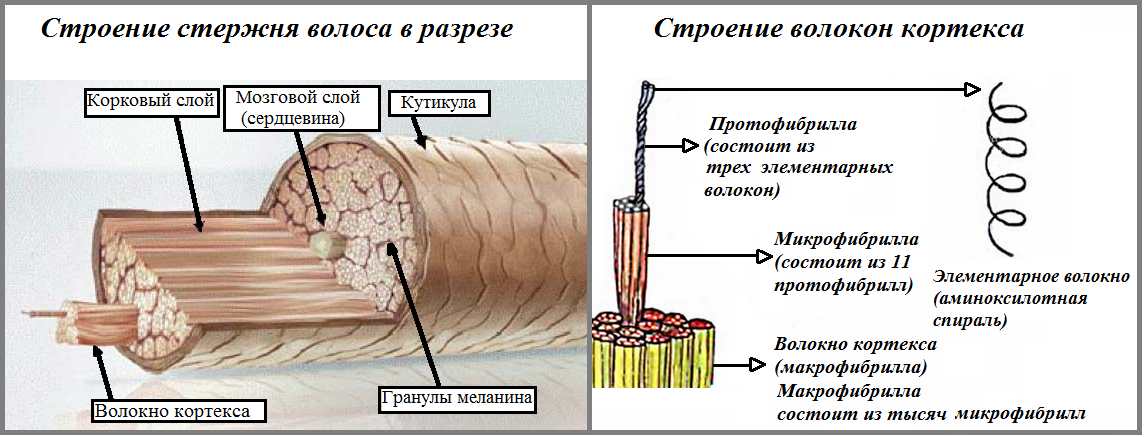
Волосяной стержень по своему строению подобен канату или трехжильному электрическому кабелю. Полипептидные цепи переплетаются между собой, образуя нити. Эти нити, в свою очередь, навиваясь друг на друга, создают супер спирализованную структуру: объединяясь по несколько штук, они формируют сначала протофибриллы волоса, затем – микрофибриллы и, наконец, самые крупные волокна – макрофибриллы.
Обвиваясь друг вокруг друга, макрофибриллы формируют основные волокна коркового слоя (кортекс — второй слой волоса).
Длинные полипептидные цепи, расположенные во «втором слое» волоса параллельно друг другу, связываются между собой образуя поперечные мостики.
Если бы не эти ковалентные связи между определенными аминокислотными остатками соседних цепей, то цепи разошлись бы и волокно бы распалось. Именно эти поперечные связи придают кератину его уникальные качества: прочность и эластичность.
Виды связей
Водородная связь — самая слабая связь, разрушается водой и изменением температуры.
Ели уложить вручную влажный волос, после его высыхания волос сохранит направление укладки. Так же происходит после использования фена с горячим воздухом.
В волосах таких связей очень много, примерно 1/3 от общей численности связей. При намокании связи разрушаются и волос легко вытягивается (парикмахер работает с мокрыми волосами). При высыхании, волос легко восстанавливается и принимает то положение, в котором оказался. Но со временем, наиболее прочные связи возвращают его в исходное положение.
Горячий воздух фена разрушает водородные связи, после остывания, волос принимает то положение, в котором оказался. Но со временем, наиболее прочные связи возвращают его в исходное положение.
Ионная связь — (*очень упрощенно) связь между молекулами.
В практике — ионная связь — это физическая реакция в химии. Физика такова, все элементы взаимодействуют друг с другом (как противоположные стороны магнита), если бы волосы были одной из одинаковых сторон магнита — мы не смогли бы ничего с ними сделать.
Молекулы состоят из атомов и атомы нейтральны — это правило, имеет заряд ноль. Если атомы имеют какой-либо заряд (плюс или минус), то молекулу которая состоит из таких атомов называют Ионом. Если говорить о таких мельчайших частицах то, всегда ионы, так как молекул в природе не бывает. Потому как нейтральных частиц в природе не существует. Молекула — это расчетная величина имеющая условный заряд ноль. В природе и окружающем нас мире, у любой частички есть свой заряд, значит и у волос есть свой заряд.
Такой вывод означает — волос состоит из 3х слоев, каждый их этих слоев состоит из отдельных элементов связанных между собой. Эти отдельные элементы состоят из элементов таблицы менделеева (которые имеют свой заряд). Сумма всех зарядов имеет итоговый знак (плюс или минус) и это применимо для любого вещества в природе, от волоса до металла. Если упрощенно — сумма таких зарядов (сумма минусов и плюсов), называется ионным зарядом.
То есть, это физический процесс в химии и он не на что не влияет. Его не нужно намеренно восстанавливать или разрушать. Эти связи определяют принцип взаимодействия веществ в природе.
Его не нужно намеренно восстанавливать или разрушать. Эти связи определяют принцип взаимодействия веществ в природе.
Дисульфидные связи (связи между двумя атомами серы) являются самыми прочными связями. При нарушении водородных связей, именно дисульфидные связи возвращают волосы в исходное состояние.
На разрыве и последующем восстановлении этих связей, основан принцип химической завивки и выпрямления волос, другие подобные процедуры.
В составе волос содержится белок кератин. В его молекуле имеется большое количество дисульфидных связей. С помощью химической завивки волосам можно придать другую форму. Для этого волосы сначала накручивают на бигуди, затем обрабатывают раствором реагента-восстановителя, разрушающего дисульфидные связи, и прогревают. В результате этого кератин приобретает иную пространственную структуру. Далее волосы промывают и обрабатывают реагентом-окислителем, при этом происходит образование новых дисульфидных связей.
Важно: обратить внимание на восстановление волоса после химического восстановления связей (после завивки или выпрямления). Такое восстановление происходит самостоятельно между атомами серы приблизительно за 1 месяц. После использования перечисленных процедур (а в них входят ботокс волос и многие другие) не рекомендуется использовать моющие средства в составе которых содержатся
Риски — необходимо избегать вымывания запечатанных элементов из структуры волоса после проведения таких процедур (так как вместе с составом вымываются атомы серы), до образования дисульфидных связей в естественной структуре волоса. Без таких связей, волос не имеет свойств прочности и эластичности. Легко ломается и травмируется. Есть риск легко испортить волосы. В таких случаях необходимо использовать безсульфатные шампуни до дня, когда эффект от таких процедур не пропадет полностью и при этом, самостоятельно.
Без таких связей, волос не имеет свойств прочности и эластичности. Легко ломается и травмируется. Есть риск легко испортить волосы. В таких случаях необходимо использовать безсульфатные шампуни до дня, когда эффект от таких процедур не пропадет полностью и при этом, самостоятельно.
Использование безсульфатных шампуней позволяет максимально долго обладать эффектом после проводимых процедур. К тому же, максимально долгое время позволяет волосам восстановиться вовремя и не упустить момент где, вымыт состав, и связи не успели восстановится.
p.s. — если бы было моющее средство без сульфатов и не проникающее в структуру волоса, показалось бы, одного выпрямления волос хватит на всю жизнь. Но поверхность волоса загрязняется, повреждается и в итоге структуру волоса необходимо очищать, увлажнять и ухаживать за ней, потому опять возвращаемся к необходимости использования вымывающих шампуней. К сожалению, любой эффект от уходовых процедур имеет временных характер.
Химические свойства волос.
 В основном состоит из кератина, волосы… | by Beauty Tomorrow
В основном состоит из кератина, волосы… | by Beauty TomorrowВолосы, в основном состоящие из кератина, также содержат другие элементы и молекулы, влияющие на их внешний вид и поведение
Общий химический состав волос: 45 % углерода, 28 % кислорода, 15 % азота, 7 % водорода и 5 % серы.
Стержень волоса в основном состоит из кератина. Кератин волос жесткий, компактный и сильный. Этот волокнистый белок постепенно образуется внутри клеток из зародышевого слоя. Эти клетки кутикулы характеризуются наличием аморфного кератина, в то время как клетки коры имеют структуру нитей, окруженных кератиновым веществом, более богатым серой и содержащим аминокислоты. Кератин этих нитей образует спираль с расстоянием между витками 0,51 нанометра и структурой, поддерживаемой водородными связями. Этот белок играет ключевую роль в сплоченности и физических свойствах волос.
Волосы в основном состоят из кератина, молекулы со спиральной структурой. © L’Oréal Research Волосы также содержат воду (от 12 до 15 %) и следы минеральных элементов (кальций, кадмий, хром, медь, цинк, железо и кремний). Эти элементы могут быть доставлены к основанию волосяного фолликула посредством кровообращения, а затем способствовать построению стержня волоса. Помимо этого вклада, окружающая среда может, например, из-за загрязнения, быть источником определенных элементов, таких как свинец.
Эти элементы могут быть доставлены к основанию волосяного фолликула посредством кровообращения, а затем способствовать построению стержня волоса. Помимо этого вклада, окружающая среда может, например, из-за загрязнения, быть источником определенных элементов, таких как свинец.
Волосы также содержат липидные компоненты (3% от их состава). Они производятся в волосяной луковице из стеролов, жирных кислот и керамидов. Присутствуя в основном в межклеточном цементе кортекса и кутикулы, они придают волосам определенную непроницаемость и обеспечивают сцепление волосяного волокна.
Другие липиды получают из секрета сальных желез: кожного сала. Кожное сало образуется из зрелых сальных клеток, которые лопнули, и в основном содержит липиды (триглицериды, воск, сквален, этерифицированный холестерин и свободный холестерин). Наиболее распространенные триглицериды подвергаются частичному гидролизу бактериями, населяющими кожу головы, Propionibacterium acnes и Propionibacterium granulosum .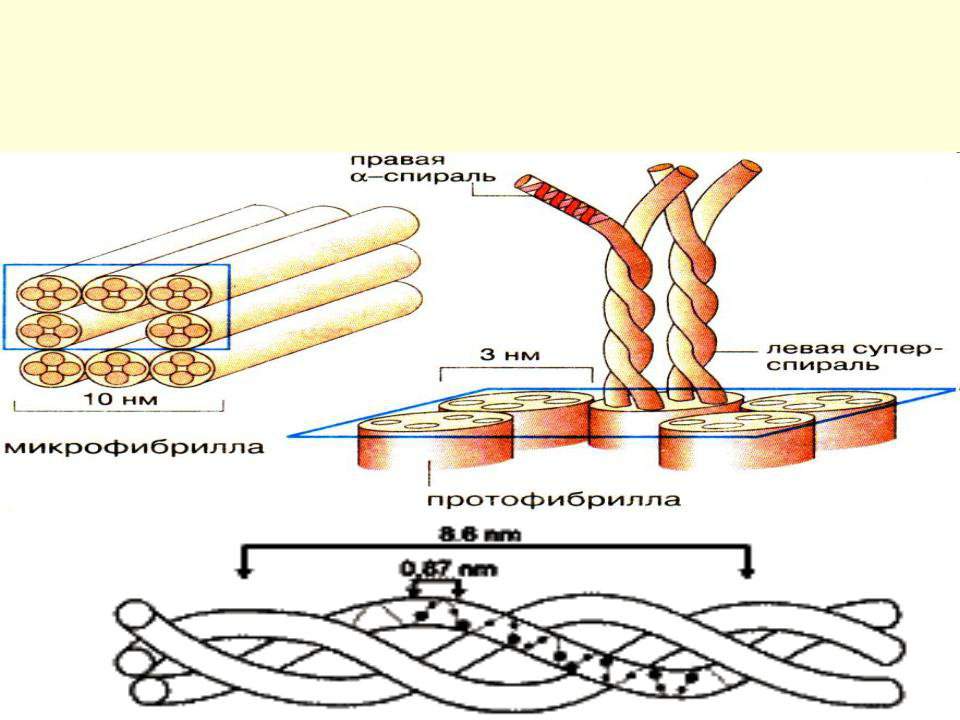 Этот гидролиз высвобождает свободные жирные кислоты, ди- и моноглицериды и глицерин. Жирные кислоты характеризуются углеродными цепями, четными и нечетными по числу (от С11 до С19), с многочисленными ненасыщенными участками и разветвлениями. Воски представляют собой сложные эфиры кислот и длинноцепочечных спиртов. Воски представляют собой неполярные соединения, которые метаболизируются флорой и мало подвержены окислению.
Этот гидролиз высвобождает свободные жирные кислоты, ди- и моноглицериды и глицерин. Жирные кислоты характеризуются углеродными цепями, четными и нечетными по числу (от С11 до С19), с многочисленными ненасыщенными участками и разветвлениями. Воски представляют собой сложные эфиры кислот и длинноцепочечных спиртов. Воски представляют собой неполярные соединения, которые метаболизируются флорой и мало подвержены окислению.
В сальных железах молекулы ацетата конденсируются с образованием мевалоновой кислоты, изомера изопреноида, и сквалена, линейного углеводорода, состоящего из 30 атомов углерода. Стерины этерифицируются жирными кислотами. Соотношение сквален/холестерин в поверхностной гидролипидной пленке является зеркалом биологической активности сальных желез и эпидермиса. Липидная смесь, которая образует эту пленку на поверхности кожи, смазывает волосы и, таким образом, сохраняет их эластичность и блеск. Из-за зависимости от гормонов кожное сало может вырабатываться в избытке, и волосы становятся жирными и тяжелыми. С другой стороны, если секрета слишком мало, волосы становятся сухими, тусклыми и поврежденными.
Из-за зависимости от гормонов кожное сало может вырабатываться в избытке, и волосы становятся жирными и тяжелыми. С другой стороны, если секрета слишком мало, волосы становятся сухими, тусклыми и поврежденными.
Структура волос человека
Armstrong et al. (2013) Армстронг С.Л., Марквардт Д., Дайс Х., Кучерка Н., Ямани З., Харрун Т.А., Катсарас Дж., Ши А.С., Райнштедтер М.С. Наблюдение высокоупорядоченных доменов в мембранах с холестерином. ПЛОС ОДИН. 2013;8:e619. doi: 10.1371/journal.pone.0066162. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Astbury & Sisson (1935) Astbury WT, Sisson WA. Рентгенологическое исследование структуры волос, шерсти и связанных с ними волокон. III. Конфигурация молекулы кератина и ее ориентация в биологической клетке. Труды Лондонского королевского общества. Серия А, Математические и физические науки. 1935;150:533–551. doi: 10.1098/rspa.1935.0121. [CrossRef] [Google Scholar]
Astbury & Street (1932) Astbury WT, Street A. Рентгеновские исследования структуры волос, шерсти и связанных с ними волокон. I. Генерал. Философские труды Лондонского королевского общества. Серия A, содержащая документы математического или физического характера. 1932; 230: 75–101. doi: 10.1098/rsta.1932.0003. [CrossRef] [Google Scholar]
Рентгеновские исследования структуры волос, шерсти и связанных с ними волокон. I. Генерал. Философские труды Лондонского королевского общества. Серия A, содержащая документы математического или физического характера. 1932; 230: 75–101. doi: 10.1098/rsta.1932.0003. [CrossRef] [Google Scholar]
Astbury & Woods (1934) Astbury WT, Woods HJ. Рентгенологическое исследование структуры волос, шерсти и связанных с ними волокон. II. Молекулярная структура и эластичные свойства кератина волос. Философские труды Лондонского королевского общества. Серия A, содержащая документы математического или физического характера. 1934;232:333–394. doi: 10.1098/rsta.1934.0010. [CrossRef] [Google Scholar]
Barrett et al. (2012) Барретт М.А., Чжэн С., Рошанкар Г., Олсоп Р.Дж., Белангер Р.К.Р., Хюинь С., Кучерка Н., Райнштадтер М.С. Взаимодействие аспирина (ацетилсалициловой кислоты) с липидными мембранами. ПЛОС ОДИН. 2012;7:e619. doi: 10.1371/journal.pone.0034357. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Barrett et al. (2013) Барретт М.А., Чжэн С., Топпозини Л.А., Олсоп Р.Дж., Дайс Х., Ван А., Яго Н., Мур М., Райнштедтер М.С. Растворимость холестерина в липидных мембранах и образование несмешивающихся холестериновых бляшек при высоких концентрациях холестерина. Мягкая материя. 2013;9: 9342–9351. doi: 10.1039/c3sm50700a. [CrossRef] [Google Scholar]
(2013) Барретт М.А., Чжэн С., Топпозини Л.А., Олсоп Р.Дж., Дайс Х., Ван А., Яго Н., Мур М., Райнштедтер М.С. Растворимость холестерина в липидных мембранах и образование несмешивающихся холестериновых бляшек при высоких концентрациях холестерина. Мягкая материя. 2013;9: 9342–9351. doi: 10.1039/c3sm50700a. [CrossRef] [Google Scholar]
Berg, Rosenberg & Asbury (1972) Berg BO, Rosenberg SH, Asbury AK. Гигантская аксональная невропатия. Педиатрия. 1972; 49: 894–899. [PubMed] [Google Scholar]
Briki et al. (2000) Briki F, Busson B, Kreplak L, Dumas P, Doucet J. Исследование биологической ткани от атомного до макроскопического масштаба с использованием синхротронного излучения: пример волос. Клеточная и молекулярная биология. 2000;46:1005–1016. [PubMed] [Академия Google]
Брики и др. (1999) Briki F, Busson B, Salicru B, Estève F, Doucet J. Диагностика рака молочной железы с помощью волос. Природа. 1999; 400: 226–226. дои: 10.1038/22244. [PubMed] [CrossRef] [Google Scholar]
Busson, Engstrom & Doucet (1999) Busson B, Engstrom P, Doucet J.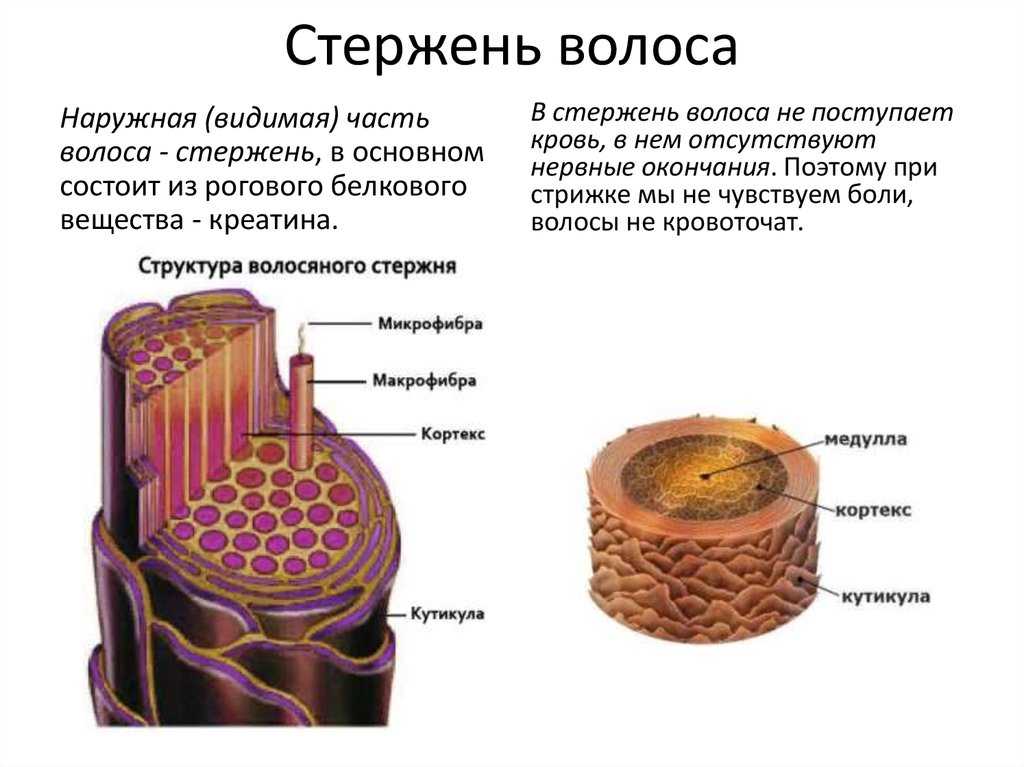 Существование различных структурных зон в ороговевших тканях, выявленное с помощью рентгеновской микродифракции. Журнал синхротронного излучения. 1999; 6: 1021–1030. doi: 10.1107/S090904959
Существование различных структурных зон в ороговевших тканях, выявленное с помощью рентгеновской микродифракции. Журнал синхротронного излучения. 1999; 6: 1021–1030. doi: 10.1107/S090904959
Cohen & Parry (1994) Коэн С., Парри Д.А. Альфа-спиральные катушки: больше фактов и лучшие прогнозы. Наука. 1994; 263:488–489. doi: 10.1126/science.8290957. [PubMed] [CrossRef] [Google Scholar]
Creasy et al. (2013) Creasy RK, Resnik R, Iams JD, Lockwood CJ, Greene MF, редакторы. Медицина матери и плода Кризи и Резника: принципы и практика. В. Б. Сондерс; 2013. [Google Scholar]
Crewther et al. (1983) Crewther WG, Dowling LM, Steinert PM, Parry DAD. Структура промежуточных филаментов. Международный журнал биологических макромолекул. 1983;5:267–274. doi: 10.1016/0141-8130(83)
-5. [CrossRef] [Google Scholar]
Crick (1952) Crick FHC. Является ли α -кератин спиральной спиралью? Природа. 1952; 170: 882–883. дои: 10.1038/170882b0. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
Franbourg et al. (2003) Franbourg A, Hallegot P, Baltenneck F, Toutaina C, Leroy F. Текущие исследования этнических волос. Журнал Американской академии дерматологии. 2003;48:S115–S119. doi: 10.1067/mjd.2003.277. [PubMed] [CrossRef] [Академия Google]
Фрейзер и др. (1986) Fraser RD, MacRae TP, Parry DA, Suzuki E. Промежуточные филаменты в альфа-кератинах. Труды Национальной академии наук Соединенных Штатов Америки. 1986; 83: 1179–1183. doi: 10.1073/pnas.83.5.1179. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Fraser, MacRae & Rogers (1962) Fraser RD, MacRae TP, Rogers GE. Молекулярная организация альфа-кератина. Природа. 1962; 193: 1052–1055. дои: 10.1038/1931052a0. [PubMed] [CrossRef] [Академия Google]
Фрейзер и др. (1988) Fraser RDB, MacRae TP, Sparrow LG, Parry DAD. Дисульфидное связывание в α -кератине. Международный журнал биологических макромолекул. 1988; 10: 106–112. doi: 10.1016/0141-8130(88)-7. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
Furt, Simon-Plas & Mongrand (2011) Furt F, Simon-Plas F, Mongrand S. In: Плазматическая мембрана растений. Мерфи А.С., Шульц Б., Пир В., редакторы. об. 19. Берлин, Гейдельберг: Springer-Verlag; 2011. С. 57–85. (Монографии о растительных клетках). [Перекрестная ссылка] [Академия Google]
Харроун и др. (1999) Harroun TA, Heller WT, Weiss TM, Yang L, Huang HW. Экспериментальные доказательства гидрофобного соответствия и мембранно-опосредованных взаимодействий в липидных бислоях, содержащих грамицидин. Биофизический журнал. 1999; 76: 937–945. doi: 10.1016/S0006-3495(99)77257-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Howell et al. (2000) Хауэлл А., Гроссманн Дж. Г., Чунг К. С., Канби Л., Д. Гарет Р. Е., Хаснайн С. С. Можно ли использовать волосы для скрининга рака молочной железы? Журнал медицинской генетики. 2000;37:297–298. doi: 10.1136/jmg.37.4.297. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Iida & Noma (1993) Iida A, Noma T. Синхротронный рентгеновский музонд и его применение для анализа человеческих волос. Ядерные приборы и методы в физических исследованиях Раздел B: Взаимодействие пучков с материалами и атомами. 1993; 82: 129–138. doi: 10.1016/0168-583X(93)95092-J. [CrossRef] [Google Scholar]
Синхротронный рентгеновский музонд и его применение для анализа человеческих волос. Ядерные приборы и методы в физических исследованиях Раздел B: Взаимодействие пучков с материалами и атомами. 1993; 82: 129–138. doi: 10.1016/0168-583X(93)95092-J. [CrossRef] [Google Scholar]
Джеймс (2001) Джеймс В. Важность хороших изображений при использовании волос для скрининга рака молочной железы. Журнал медицинской генетики. 2001;38:e619. doi: 10.1136/jmg.38.5.e16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Veronica & Amemiya (1998) James VJ, Amemiya Y. Упаковка промежуточных нитей в α -кератине пера ехидны. Журнал текстильных исследований. 1998; 68: 167–170. doi: 10.1177/004051759806800303. [CrossRef] [Google Scholar]
Джеймс и др. (1999) Джеймс В., Кирсли Дж., Ирвинг Т., Амемия Й., Куксон Д. Использование волос для скрининга рака молочной железы. Природа. 1999; 398:33–34. дои: 10.1038/17949. [PubMed] [CrossRef] [Академия Google]
Каджиура и др.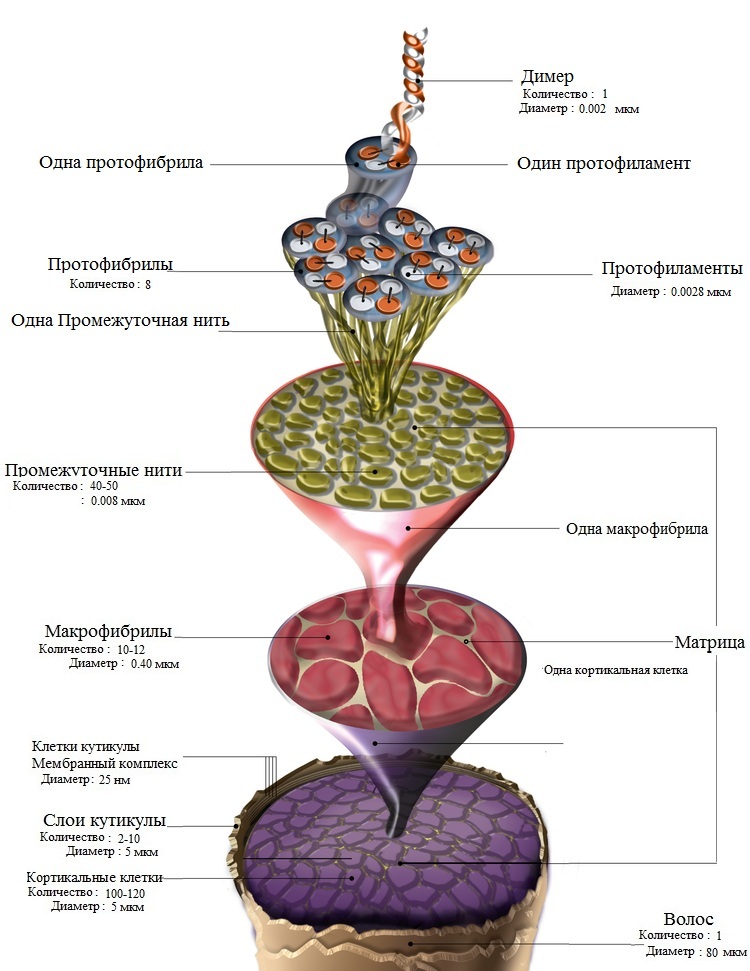 (2006) Kajiura Y, Watanabe S, Itou T, Nakamura K, Iida A, Inoue K, Yagi N, Shinohara Y, Amemiya Y. Структурный анализ одиночных волокон человеческого волоса путем сканирования микролучевых саксофонов. Журнал структурной биологии. 2006; 155: 438–444. doi: 10.1016/j.jsb.2006.04.008. [PubMed] [CrossRef] [Google Scholar]
(2006) Kajiura Y, Watanabe S, Itou T, Nakamura K, Iida A, Inoue K, Yagi N, Shinohara Y, Amemiya Y. Структурный анализ одиночных волокон человеческого волоса путем сканирования микролучевых саксофонов. Журнал структурной биологии. 2006; 155: 438–444. doi: 10.1016/j.jsb.2006.04.008. [PubMed] [CrossRef] [Google Scholar]
Katsaras et al. (1995) Katsaras J, Raghunathan VA, Dufourc EJ, Dufourcq J. Доказательства двумерной молекулярной решетки в бислоях dppc субгелевой фазы. Биохимия. 1995;34:4684–4688. doi: 10.1021/bi00014a023. [PubMed] [CrossRef] [Google Scholar]
Kreplak et al. (2001a) Kreplak L, Briki F, Duvault Y, Doucet J, Merigoux C, Leroy F, Lévêque JL, Miller L, Carr GL, Williams GP, Dumas P. Профилирование липидов в поперечных стрижках кавказских и афроамериканских волос с использованием синхротрона инфракрасная микроспектрометрия. Международный журнал косметической науки. 2001а; 23:369–374. doi: 10.1046/j.0412-5463.2001.00118.x. [PubMed] [CrossRef] [Google Scholar]
Kreplak et al. (2001b) Креплак Л., Меригу С., Брики Ф., Флот Д., Дусе Дж. Исследование структуры кутикулы человеческого волоса с помощью микродифракции: прямое наблюдение за набуханием комплекса клеточной мембраны. Biochimica et Biophysica Acta (BBA) — структура белка и молекулярная энзимология. 2001b; 1547: 268–274. дои: 10.1016/S0167-4838(01)00195-9. [PubMed] [CrossRef] [Google Scholar]
(2001b) Креплак Л., Меригу С., Брики Ф., Флот Д., Дусе Дж. Исследование структуры кутикулы человеческого волоса с помощью микродифракции: прямое наблюдение за набуханием комплекса клеточной мембраны. Biochimica et Biophysica Acta (BBA) — структура белка и молекулярная энзимология. 2001b; 1547: 268–274. дои: 10.1016/S0167-4838(01)00195-9. [PubMed] [CrossRef] [Google Scholar]
Kučerka et al. (2005) Кучерка Н., Лю Ю., Чу Н., Петраче Х.И., Тристрам-Нэгл С., Нэгл Дж. Ф. Структура липидных бислоев полностью гидратированной жидкой фазы DMPC и DLPC с использованием рассеяния рентгеновских лучей от ориентированных многослойных массивов и от однослойных везикул. Биофизический журнал. 2005; 88: 2626–2637. doi: 10.1529/biophysj.104.056606. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Kuč, Tristram-Nagle & Nagle (2006) Kučerka N, Tristram-Nagle S, Nagle JF. Более пристальный взгляд на структуру полностью гидратированных двойных слоев dppc жидкой фазы. Биофизический журнал. 2006;90:L83–L85. doi: 10.1529/biophysj.106.086017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2006;90:L83–L85. doi: 10.1529/biophysj.106.086017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Lupas & Gruber (2005) Lupas AN, Gruber M. Структура α — спиральных спиральных катушек. Достижения в области химии белков. 2005; 70:37–38. [PubMed] [Google Scholar]
Mercer (1953) Mercer EH. Неоднородность кератиновых волокон. Журнал текстильных исследований. 1953; 23: 388–397. doi: 10.1177/004051755302300603. [CrossRef] [Google Scholar]
Mills et al. (2009 г.) Миллс Т.Т., Хуанг Дж., Фейгенсон Г.В., Нэгл Дж.Ф. Влияние холестерина и ненасыщенного липида доппероксидазы на упаковку цепей насыщенных бислоев дппк в гелевой фазе. Общая физиология и биофизика. 2009; 28: 126–139. doi: 10.4149/gpb_2009_02_126. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Mills et al. (2008) Миллс Т.Т., Тумбес Г.Е.С., Тристрам-Нэгл С., Смилгис Д.М., Фейгенсон Г.В., Нэгл Дж.Ф. Параметры порядка и области в жидкофазно-ориентированных липидных мембранах с использованием широкоугольного рассеяния рентгеновских лучей. Биофизический журнал. 2008;95: 669–681. doi: 10.1529/biophysj.107.127845. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Биофизический журнал. 2008;95: 669–681. doi: 10.1529/biophysj.107.127845. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Nussbaum et al. (2007) Nussbaum RL, McInnes RR, Willard HF, Hamosh A. Принципы молекулярного заболевания: уроки гемоглобинопатий. Генетика Томпсона и Томпсона в медицине. 2007;т. 6: 181–202. [Google Scholar]
Охта и др. (2005) Охта Н., Ока Т., Иноуэ К., Яги Н., Като С., Хатта И. Структурный анализ комплекса клеточной мембраны волосяного волокна с помощью микролучевой рентгеновской дифракции. Журнал прикладной кристаллографии. 2005; 38: 274–279.. doi: 10.1107/S002188980403403X. [CrossRef] [Google Scholar]
Pan et al. (2008) Пан Дж., Миллс Т.Т., Тристрам-Нэгл С., Нэгл Дж.Ф. Холестерин неуниверсально возмущает липидные бислои. Письма о физическом обзоре. 2008;100:198103. doi: 10.1103/PhysRevLett.100.198103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Pauling & Corey (1950) Pauling L, Corey RB. Две спиральные конфигурации полипептидной цепи, связанные водородными связями. Журнал Американского химического общества. 1950;72:5349–5349. doi: 10.1021/ja01167a545. [CrossRef] [Google Scholar]
Журнал Американского химического общества. 1950;72:5349–5349. doi: 10.1021/ja01167a545. [CrossRef] [Google Scholar]
Pauling & Corey (1951) Pauling L, Corey RB. Структура волос, мышц и связанных с ними белков. Труды Национальной академии наук Соединенных Штатов Америки. 1951; 37: 261–271. doi: 10.1073/pnas.37.5.261. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Petrache et al. (1998) Петраче Х.И., Гуляев Н., Тристрам-Нагл С., Чжан Р., Сутер Р.М., Нэгл Дж.Ф. Межбислойные взаимодействия в рентгеновском рассеянии высокого разрешения. Физический обзор E. 1998;57:7014–7024. doi: 10.1103/PhysRevE.57.7014. [CrossRef] [Google Scholar]
Пинто и др. (2014) Пинто Н., Ян Ф.К., Негиши А., Райнштедтер М.С., Гиллис Т.Э., Фадж Д.С. Самосборка повышает прочность волокон, состоящих из белков промежуточных филаментов виментина. Биомакромолекулы. 2014; 15: 574–581. doi: 10.1021/bm401600a. [PubMed] [CrossRef] [Google Scholar]
Poinapen et al. (2013) Poinapen D, Toppozini L, Dies H, Brown DCW, Rheinstädter MC.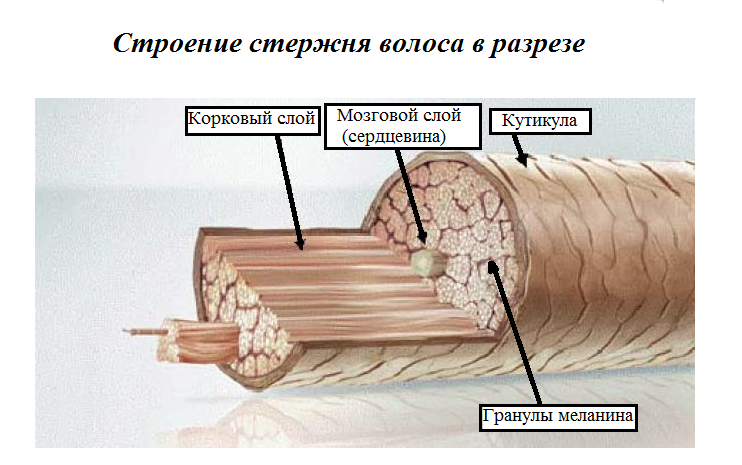 Статические магнитные поля улучшают порядок липидов в нативной плазматической мембране растений. Мягкая материя. 2013;9: 6804–6813. doi: 10.1039/c3sm50355k. [CrossRef] [Google Scholar]
Статические магнитные поля улучшают порядок липидов в нативной плазматической мембране растений. Мягкая материя. 2013;9: 6804–6813. doi: 10.1039/c3sm50355k. [CrossRef] [Google Scholar]
Rafik, Doucet & Briki (2004) Rafik MEr, Doucet J, Briki F. Архитектура промежуточных филаментов, определенная с помощью рентгеновского дифракционного моделирования твердого α -кератина. Биофизический журнал. 2004; 86: 3893–3904. doi: 10.1529/biophysj.103.034694. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Randebrook (1964) Randebrook RJ. Neue erkenntnisse über den morphologischen aufbau des menschlichen haares. Журнал Общества косметических химиков. 1964;15:691–706. [Google Scholar]
Rappolt & Rapp (1996) Rappolt M, Rapp G. Одновременная мало- и широкоугольная дифракция рентгеновских лучей во время основного перехода димиристоилфосфатидилэтаноламина. Berichte der Bunsengesellschaft и Physikalische Chemie. 1996; 7: 1153–1162. doi: 10.1002/bbpc.19961000710. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
Rheinstädter et al. (2008) Rheinstädter MC, Das J, Flenner EJ, Brüning B, Seydel T, Kosztin I. Когерентность движения в жидких фосфолипидных мембранах. Письма о физическом обзоре. 2008;101:248106. doi: 10.1103/PhysRevLett.101.248106. [PubMed] [CrossRef] [Академия Google]
Rheinstädter et al. (2004) Rheinstädter MC, Ollinger C, Fragneto G, Demmel F, Salditt T. Коллективная динамика липидных мембран, изученная методом неупругого рассеяния нейтронов. Письма о физическом обзоре. 2004;93:108107. doi: 10.1103/PhysRevLett.93.108107. [PubMed] [CrossRef] [Google Scholar]
Rheinstädter, Seydel & Salditt (2007) Rheinstädter MC, Seydel T, Salditt T. Наносекундная молекулярная релаксация в липидных бислоях, изученная с помощью рассеяния нейтронов с высоким энергетическим разрешением и дифракции на месте. Физическое обозрение Е. 2007; 75:011907. doi: 10.1103/PhysRevE.75.011907. [PubMed] [CrossRef] [Google Scholar]
Robbins (2012) Robbins CR. Химическое и физическое поведение человеческих волос. 5-е изд. Нью-Йорк: Спрингер; 2012. [Google Scholar]
Химическое и физическое поведение человеческих волос. 5-е изд. Нью-Йорк: Спрингер; 2012. [Google Scholar]
Rogers (1959) Rogers GE. Электронная микроскопия шерсти. Журнал ультраструктурных исследований. 1959; 2: 309–330. doi: 10.1016/S0022-5320(59)80004-6. [PubMed] [CrossRef] [Google Scholar]
Schneggenburger et al. (2011) Schneggenburger P, Beerlink A, Weinhausen B, Salditt T, Diederichsen U. Спирали пептидной модели в липидных мембранах: вставка, расположение и ответ липидов на агрегацию, изученные с помощью рентгеновского рассеяния. Европейский биофизический журнал. 2011;40:417–436. дои: 10.1007/s00249-010-0645-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Swift & Smith (2001) Swift JA, Smith JR. Микроскопические исследования эпикутикулы кератиновых волокон млекопитающих. Журнал микроскопии. 2001; 204: 203–211. doi: 10.1046/j.1365-2818.2001.00957.x. [PubMed] [CrossRef] [Google Scholar]
Tristram-Nagle et al. (2002) Тристрам-Нэгл С., Лю Ю. , Леглейтер Дж., Нэгл Дж. Ф. Структура гелевой фазы dmpc определена методом рентгеноструктурного анализа. Биофизический журнал. 2002; 83: 3324–3335. дои: 10.1016/S0006-3495(02)75333-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Леглейтер Дж., Нэгл Дж. Ф. Структура гелевой фазы dmpc определена методом рентгеноструктурного анализа. Биофизический журнал. 2002; 83: 3324–3335. дои: 10.1016/S0006-3495(02)75333-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ward & Lundgren (1954) Ward WH, Lundgren HP. Образование, состав и свойства кератинов. Достижения в области химии белков. 1954; 9: 243–297. [PubMed] [Google Scholar]
Welti et al. (1981) Велти Р., Ринтоул Д.А., Гудсаид-Залдуондо Ф., Фелдер С., Силберт Д.Ф. Фосфолипиды гель-фазы в плазматической мембране истощенных по стеролам клеток lm мыши. Журнал биологической химии. 1981; 256:7528–7535. [PubMed] [Академия Google]
Wilk, James & Amemiya (1995) Wilk KE, James VJ, Amemiya Y. Структура промежуточных нитей человеческого волоса. Biochimica et Biophysica Acta (BBA) — общие предметы. 1995;1245:392–396. doi: 10.1016/0304-4165(95)00111-5. [PubMed] [CrossRef] [Google Scholar]
Yang et al. (2014) Ян Ф.К., Петерс Р.Д., Дайс Х.